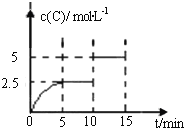
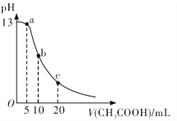
题目内容
【题目】25℃时,在等体积的①pH=0的H2SO4溶液,②0.05 mol/L的Ba(OH)2溶液③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
【答案】A
【解析】
25℃时,①pH=0的H2SO4溶液中c(H+)=1.00 mol/L,水电离出的c(OH-)=c(H+)=![]() =
=![]() mol/L=10-14 mol/L;
mol/L=10-14 mol/L;
②0.05 mol/L的Ba(OH)2溶液中c(OH-)=2c[Ba(OH)2]=2×0.05 mol/L=0.1 mol/L,水电离出的c(H+)=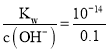 mol/L=10-13 mol/L;
mol/L=10-13 mol/L;
③pH=10的Na2S溶液中水电离出的c(H+)= c(OH-)=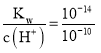 mol/L=10-4 mol/L;
mol/L=10-4 mol/L;
④pH=5的NH4NO3溶液中水电离出的c(H+)=10-5 mol/L;
则在等体积的①pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,则由水电离产生的H+浓度之比=10-14 mol/L:10-13 mol/L:10-4 mol/L:10-5 mol/L=1:10:1010:109,故合理选项是A。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
【题目】为测定一置于空气中的某硫酸酸化的FeSO4溶液中Fe2+被氧化的百分率,某同学准确量取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0g;再另取同样的FeSO4溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g.
(1)写出反应中涉及的化学方程式(至少3个)__、__、__
(2)通过计算,填写下表:
c(H+) | c(SO42﹣) | c(Fe2+、Fe3+) |
__ | __ | __ |
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度
(3)计算原溶液中Fe2+被氧化的百分率__.