题目内容
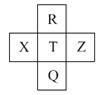
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
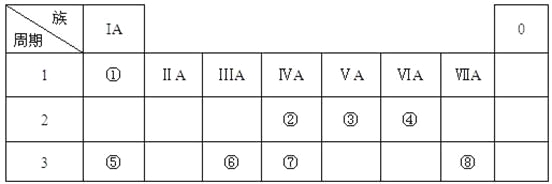
(1)④、⑤、⑥的原子半径由大到小的顺序为______________。
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是__________。
(3)③的气态氢化物的电子式_____。
(4)⑤的最高价氧化物对应水化物的溶液与单质⑥、单质⑧分别反应的离子方程式___、____。
(5)单质①在单质⑧中燃烧,火焰为__________色。
【答案】Na>Al>O HClO4>H2CO3>H2SiO3 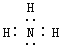 2Al+2OH-+2H2O=2AlO2-+3H2↑ Cl2+2OH-= Cl-+ ClO-+ H2O 苍白
2Al+2OH-+2H2O=2AlO2-+3H2↑ Cl2+2OH-= Cl-+ ClO-+ H2O 苍白
【解析】
由周期表相对位置可知,①为H元素、②为C元素、③为N元素、④为O元素、⑤为Na元素、⑥为Al元素、⑦为Si元素、⑧为Cl元素。
(1)根据元素周期表和元素周期律可知,原子半径随电子层数的增多而增大,随核电荷数的增多而减小,则④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O,故答案为:Na>Al>O;
(2)同周期元素,原子序数越大,非金属性越强;同种族元素,原子序数愈小,非金属性越强,则②、⑧、⑦三种元素的非金属性Cl>C>Si,最高价氧化物的水化物的酸性由强到弱的顺序是HClO4>H2CO3>H2SiO3,故答案为:HClO4>H2CO3>H2SiO3;
(3)③的气态氢化物是氨气,氨气是共价化合物,空间构型为三角锥形,电子式是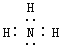 ,故答案为:
,故答案为: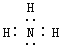 ;
;
(4)⑤为Na元素,最高价氧化物对应水化物为NaOH,单质⑥、单质⑧分别是Al、Cl2,均与氢氧化钠溶液反应,反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑,Cl2+2OH-= Cl-+ ClO-+ H2O,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Cl2+2OH-= Cl-+ ClO-+ H2O;
(5)氢气在氯气中燃烧的火焰为苍白色,故答案为:苍白。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】为测定一置于空气中的某硫酸酸化的FeSO4溶液中Fe2+被氧化的百分率,某同学准确量取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0g;再另取同样的FeSO4溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g.
(1)写出反应中涉及的化学方程式(至少3个)__、__、__
(2)通过计算,填写下表:
c(H+) | c(SO42﹣) | c(Fe2+、Fe3+) |
__ | __ | __ |
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度
(3)计算原溶液中Fe2+被氧化的百分率__.