��Ŀ����
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ����ǿ�������Դ�����п�����Ӧ�õĹ���ǰ����
��1����֪��CH3OH(g)=HCHO(g)+H2(g) ��H=+84kJmol1��2H2(g)+O2(g)�T2H2O(g)��H=484kJmol1����ҵ�ϳ��Լ״�Ϊԭ����ȡ��ȩ����д��CH3OH(g)��O2(g)��Ӧ����HCHO(g)��H2O(g)���Ȼ�ѧ����ʽ______________��
��2����ҵ���ں����ܱ������пɲ������з�Ӧ�ϳɼ״�CO(g)+2H2(g)![]() CH3OH(g)��H
CH3OH(g)��H
�����жϸ÷�Ӧ�ﵽƽ��״̬��������_________(��ĸ���)��
A��2 ����(H2) = �� ��(CO)
B�����������ܶȲ���
C����������ƽ����Է�����������
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
E��������CO��H2��CH3OH��Ũ��֮��Ϊ1:2:1
F��CO��H2��CH3OH������֮��Ϊ1:2:1
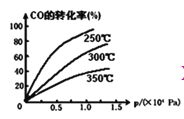
��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ���÷�Ӧ��H_______0���������������
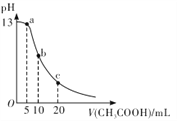
��һ���¶���,��4a mol H2��2a mol CO����2L���ܱ������У���ַ�Ӧ����CO��ת����Ϊ50������÷�Ӧ��ƽ�ⳣ��Ϊ_______________��
���𰸡�2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)��H=-316kJmol-1 CD �� ![]() L2mol-2
L2mol-2
��������
(1)���ݸ�˹���ɷ�����дCH3OH(g)��O2(g)��Ӧ����HCHO(g)��H2O(g)�Ȼ�ѧ����ʽ��
(2)�ٸ��ݷ�Ӧ�ﵽƽ��״̬�����������жϣ�����ͬѹǿ�£��¶�Խ�ߣ�COת����ԽС��˵�������¶ȣ�ƽ�����淴Ӧ�����ƶ����۸�������ʽ����ƽ�ⳣ����
(1)I.CH3OH(g)�THCHO(g)+H2(g)��H=+84kJmol-1����.2H2(g)+O2(g)�T2H2O(g) ��H=-484kJmol-1�����ݸ�˹���ɣ�����2+��ã�2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)��H=(84��2-484)kJmol-1=-316kJmol-1���ʴ�Ϊ��2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) ��H=-316kJmol-1��
(2)��A�����ݷ���ʽCO(g)+2H2(g)![]() CH3OH(g)��2v��(CO)=v��(H2)����2����(H2)=����(CO)����˵���÷�Ӧ�ﵽƽ��״̬����A����
CH3OH(g)��2v��(CO)=v��(H2)����2����(H2)=����(CO)����˵���÷�Ӧ�ﵽƽ��״̬����A����
B����Ӧǰ���������������䣬����������䣬����������ܶ�ʼ�ղ��䣬�ʻ��������ܶȲ��䲻��˵���÷�Ӧ�ﵽƽ��״̬����B����
C����Ӧǰ���������������䣬������������ʵ����ڱ仯����˻�������ƽ����Է����������䣬�ܹ�˵������������ʵ������䣬��˵���÷�Ӧ�ﵽƽ��״̬����C��ȷ��
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯���������Ũ�Ȳ��䣬��˵���÷�Ӧ�ﵽƽ��״̬����D��ȷ��
E��������CO��H2��CH3OH��Ũ��֮��Ϊ1��2��1������˵�������Ũ�Ȳ��䣬�ʲ���˵���÷�Ӧ�ﵽƽ��״̬����E����
F�����ݷ���ʽ��CO��H2��CH3OH������֮��ʼ��Ϊ1��2��1������˵������Ӧ���ʵ����淴Ӧ���ʣ��ʲ���˵���÷�Ӧ�ﵽƽ��״̬����F����
CD��ȷ���ʴ�Ϊ��CD��
����ͼ��֪����ͬѹǿ�£��¶�Խ�ߣ�CO��ת����Խ�ͣ�˵�������¶ȣ�ƽ�����淴Ӧ�����ƶ�����÷�ӦΪ���ȷ�Ӧ����H��0���ʴ�Ϊ������
�������⽨����������ʽ��
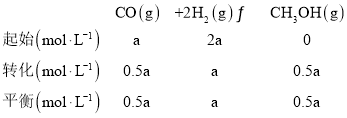
K= =
=![]() =
=![]() L2mol-2���ʴ�Ϊ��
L2mol-2���ʴ�Ϊ��![]() L2mol-2��
L2mol-2��

 ������ѧ���̲���ȫ���ϵ�д�
������ѧ���̲���ȫ���ϵ�д� ������ʱ����ҵ����ϵ�д�
������ʱ����ҵ����ϵ�д�����Ŀ��Ϊ�ⶨһ���ڿ����е�ij�����ữ��FeSO4��Һ��Fe2+�������İٷ��ʣ�ijͬѧȷ��ȡpH=1������Fe2+��Fe3+��ˮ�⣩��FeSO4��Һ200mL���������BaCl2��Һ����ַ�Ӧ����ˡ�ϴ�ӡ�����õ�����28.0g������ȡͬ����FeSO4��Һ200mL�������м������NaOH��Һ������ʹ���ַ�Ӧ��������ȫ����Ϊ���ɫ���ˡ�ϴ�Ӳ��������ù��壬���յù���8.0g��
��1��д����Ӧ���漰�Ļ�ѧ����ʽ������3����__��__��__
��2��ͨ�����㣬��д�±���
c��H+�� | c��SO42���� | c��Fe2+��Fe3+�� |
__ | __ | __ |
ע��c��Fe2+��Fe3+����ʾFe2+��Fe3+���ܵ����ʵ�����Ũ��
��3������ԭ��Һ��Fe2+�������İٷ���__��