题目内容
【题目】甲、乙两醋酸稀溶液,甲的pH=a,乙的pH=a+1,下列判断正确的是( )
A.甲中由水电离出来的H+的物质的量浓度是乙的![]()
B.甲、乙两溶液物质的量浓度之间的关系:c(甲)=10c(乙)
C.用甲、乙分别中和含有等物质的量的NaOH溶液, 两者的体积(V)之间的关系为10V(甲)>V(乙)
D.甲中的c(OH-)为乙中的c(OH-)的10倍
【答案】A
【解析】
A.pH=-lgc(H+),c(H+)=10-pH,所以c(H+)甲=10-a,c(H+)乙=10-(a+1),所以c(H+)甲=10 c(H+)乙,酸溶液中水电离出的c(H+)等于溶液中c(OH-),c(OH-)=![]() ,所以c(OH-):10 c(OH-)甲= c(OH-)乙,则水电离出的氢离子浓度10 c(H+)甲= c(H+)乙,A正确;
,所以c(OH-):10 c(OH-)甲= c(OH-)乙,则水电离出的氢离子浓度10 c(H+)甲= c(H+)乙,A正确;
B.弱酸的浓度越大,酸的电离程度越小,醋酸为弱酸,c(H+)甲=10-a,c(H+)乙=10-(a+1),所以甲、乙两种溶液的浓度:c(甲)>10c(乙),B错误;
C.弱酸的浓度越大,酸的电离程度越小,醋酸与等量NaOH反应,醋酸的浓度越大则消耗酸的体积越小,c(甲)>10c(乙),所以消耗醋酸的体积,10V(甲)<V(乙),C错误;
D.c(OH-)=![]() ,所以氢氧根离子浓度:10 c(OH-)甲= c(OH-)乙,D错误;
,所以氢氧根离子浓度:10 c(OH-)甲= c(OH-)乙,D错误;
故答案选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
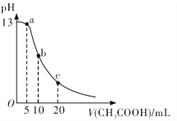
目标测试系列答案【题目】为测定一置于空气中的某硫酸酸化的FeSO4溶液中Fe2+被氧化的百分率,某同学准确量取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0g;再另取同样的FeSO4溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g.
(1)写出反应中涉及的化学方程式(至少3个)__、__、__
(2)通过计算,填写下表:
c(H+) | c(SO42﹣) | c(Fe2+、Fe3+) |
__ | __ | __ |
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度
(3)计算原溶液中Fe2+被氧化的百分率__.