题目内容
11.设NA 为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 25℃时,pH=1的醋酸溶液中含有H+的数目为0.1NA | |
| B. | 100mL 18.4mol•L-1 的浓硫酸与足量的铜加热反应后,生成SO2 分子数为0.92NA | |
| C. | 将CO2 通过Na2O2 ,当固体质量增加a g时,反应中转移的电子数为a$\frac{{N}_{A}}{28}$ | |
| D. | 标准状况下,11.2L正丁烷所含公用电子对数为7NA |
分析 A、溶液体积不明确;
B、铜只能与浓硫酸反应;
C、过氧化钠和二氧化碳反应增重相当于CO的质量,结合化学方程式计算电子转移;
D、标况下,正丁烷为液态.
解答 解:A、溶液体积不明确,故醋酸溶液中的氢离子个数无法计算,故A错误;
B、铜只能与浓硫酸反应生成二氧化硫,一但硫酸变稀,则反应停止,故100mL 18.4mol•L-1 的浓硫酸不能完全反应,则生成的二氧化硫的物质的量小于0.92mol,即分子个数小于0.92NA个,故B错误;
C、将CO2 通过Na2O2 中:2CO2 +2Na2O2 =2Na2CO3+O2↑,每当增重28g,转移1mol电子,故当增重ag时,转移$\frac{a}{28}$mol电子,即$\frac{a•{N}_{A}}{28}$个,故C正确;
D、标况下,正丁烷为液态,不能根据气体摩尔体积来计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
2.已知2H2O2(l)═2H2O(l)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是( )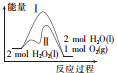

| A. | 途径Ⅱ与途径Ⅰ相比,可能是加入了二氧化锰 | |
| B. | 2 molH2O2(l)的能量高于2 molH2O(l)的能量 | |
| C. | 其他条件相同,产生相同量氧气时放出的热量:途径Ⅰ大于途径Ⅱ | |
| D. | 其他条件相同,产生相同量氧气耗时:途径Ⅰ大于途径Ⅱ |
19.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 通过红外光谱分析可以区分乙醇与乙酸乙酯 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| C. | 淀粉可用于制备葡萄糖、酿制食醋,还可作药片的赋形剂 | |
| D. | 利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 |
16.下列各项实验的基本操作中,正确的是( )
| A. | 为了加快过滤速度,可用玻璃棒搅拌过滤器中的液体 | |
| B. | 为了防止容量瓶漏液,可在玻璃塞上涂上凡士林 | |
| C. | 为了使制取氢气的速率加快,可向稀硫酸中加入少量硫酸铜溶液 | |
| D. | 为了使配制的FeCl3溶液不产生混浊,可加入盐酸和铁片 |
20. 短周期元素X、Y、Z、W在周期表中相对位置如图所示,Y元素在地壳中的含量最高.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中相对位置如图所示,Y元素在地壳中的含量最高.下列说法正确的是( )
 短周期元素X、Y、Z、W在周期表中相对位置如图所示,Y元素在地壳中的含量最高.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中相对位置如图所示,Y元素在地壳中的含量最高.下列说法正确的是( )| A. | 原子半径:Z<Y<W | |
| B. | 最简单气态氢化物的热稳定性:Y<W | |
| C. | 含X的化合物形成的溶液一定呈酸性 | |
| D. | Y的最简单阴离子和Z的最简单阳离子核外电子数相同 |
6.下列结论错误的是( )
| A. | 氧化性:F2>Cl2>S | B. | 稳定性:HF>HCl>H2S>PH3 | ||
| C. | 离子半径:K+>Al3+>S2->Cl- | D. | 酸性:HClO4>H2SO4>H3PO4>HClO |