题目内容
5.在100mL硝酸和硫酸的混合溶液中,c(HNO3)=0.2mol/L,c(H2SO4)=0.4mol/L,向其中加入2.56g铜粉,微热,充分反应后溶液中c(Cu2+)为(反应前后溶液体积保持不变)( )| A. | 0.40mol/L | B. | 0.30mol/L | C. | 0.075mol/L | D. | 无法计算 |
分析 n(Cu)=$\frac{2.56g}{64g/mol}$=0.04mol,混合溶液中n(H+)=n(HNO3)+2n(H2SO4)=0.2mol/L×0.1L+2×0.4mol/L×0.1L=0.1mol,n(NO3-)=n(HNO3)=0.2mol/L×0.1L=0.02mol,Cu和混合酸的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,根据离子方程式知,0.02mol硝酸根离子完全反应需要0.03molCu、0.08mol氢离子,所以Cu、氢离子都剩余,则Cu完全溶解,根据Cu原子守恒计算c(Cu2+).
解答 解:n(Cu)=$\frac{2.56g}{64g/mol}$=0.04mol,混合溶液中n(H+)=n(HNO3)+2n(H2SO4)=0.2mol/L×0.1L+2×0.4mol/L×0.1L=0.1mol,n(NO3-)=n(HNO3)=0.2mol/L×0.1L=0.02mol,Cu和混合酸的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,根据离子方程式知,0.02mol硝酸根离子完全反应需要0.03molCu、0.08mol氢离子,所以Cu、氢离子都剩余,则Cu完全溶解,根据Cu原子守恒得溶解的n(Cu2+)=n(Cu)=0.03mol,c(Cu2+)=$\frac{0.03mol}{0.1L}$=0.30mol/L,
故选B.
点评 本题考查氧化还原反应有关计算,为高频考点,侧重考查学生分析计算能力,注意:该反应计算铜离子浓度时要先进行过量计算,为易错题.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案
相关题目
13.将一小块金属钠投入足量的下列溶液中,既能生成气体,又能生成白色沉淀的是( )
| A. | 稀盐酸 | B. | Ba(OH)2稀溶液 | C. | MgCl2溶液 | D. | CuSO4溶液 |
17.已知下列元素的原子半径:根据上表数据分析,磷原子半径可能是( )
| 原子 | N | S | Si |
| 半径r/10-10m | 0.75 | 1.02 | 1.17 |
| A. | 1.10×10-10m | B. | 0.70×10-10m | C. | 1.20×10-10m | D. | 0.80×10-10m |
14.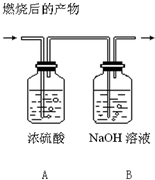 下列气体在足量的氧气中充分燃烧,产生二氧化碳和水两种物质,将产物依次通过如图中A、B装置,经完全吸收后,测得浓硫酸质量增加9g,氢氧化钠溶液增加11g,则气体可能是下列气体中的( )
下列气体在足量的氧气中充分燃烧,产生二氧化碳和水两种物质,将产物依次通过如图中A、B装置,经完全吸收后,测得浓硫酸质量增加9g,氢氧化钠溶液增加11g,则气体可能是下列气体中的( )
 下列气体在足量的氧气中充分燃烧,产生二氧化碳和水两种物质,将产物依次通过如图中A、B装置,经完全吸收后,测得浓硫酸质量增加9g,氢氧化钠溶液增加11g,则气体可能是下列气体中的( )
下列气体在足量的氧气中充分燃烧,产生二氧化碳和水两种物质,将产物依次通过如图中A、B装置,经完全吸收后,测得浓硫酸质量增加9g,氢氧化钠溶液增加11g,则气体可能是下列气体中的( )| A. | C2H2 | B. | C2H5OH 蒸汽 | ||
| C. | CH4 | D. | CH4与H2的混合气体 |
15.下列转变需加入还原剂的是( )
| A. | CO→CO2 | B. | FeCl2 →FeCl3 | C. | Na2SO3 →SO2 | D. | CuO→Cu |
 咖啡酸(见图),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.
咖啡酸(见图),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好. .
. ,咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为
,咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为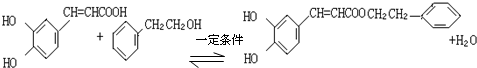 .
.