题目内容
10.请选择合适方法的字母代号填空:(1)从煤焦油中提取二甲苯C; (2)从海水中提取粗盐J;
(3)十六烷转变为辛烷和辛烯D; (4)轻柴油转变为乙烯、丙烯等不饱和烃B;
(5)煤转化为焦炭、煤焦油等E;(6)工业上由氧化铝制取金属铝G;
(7)从铁矿石中提取金属铁F;
A.过滤 B.裂解 C.分馏 D.裂化 E.干馏 F.还原
G.电解 H.溶解 I.渗析 J.蒸发 K.氧化.
分析 (1)煤焦油中提取二甲苯,利用沸点不同分离;
(2)海水中提取粗盐,NaCl溶于水,蒸发即可;
(3)十六烷转变为辛烷和辛烯,大分子转化为小分子,为裂化反应;
(4)轻柴油转变为乙烯、丙烯等不饱和烃,为裂解反应;
(5)煤转化为焦炭、煤焦油等,为干馏;
(6)工业上由氧化铝制取金属铝,利用电解原理生成Al和氧气;
(7)从铁矿石中提取金属铁,利用还原反应得到Fe.
解答 解:(1)煤焦油中提取二甲苯,利用沸点不同分离,则选择C,故答案为:C;
(2)海水中提取粗盐,NaCl溶于水,蒸发即可,则选择J,故答案为:J;
(3)十六烷转变为辛烷和辛烯,大分子转化为小分子,为裂化反应,故答案为:D;
(4)轻柴油转变为乙烯、丙烯等不饱和烃,为裂解反应,故答案为:B;
(5)煤转化为焦炭、煤焦油等,为干馏,故答案为:E;
(6)Al为活泼金属,工业上由氧化铝制取金属铝,利用电解原理生成Al和氧气,故答案为:G;
(7)从铁矿石中提取金属铁,利用还原反应从铁的氧化物中得到Fe,则选择F,故答案为:F.
点评 本题考查物质的分离方法及选择、金属冶炼、石油产品的利用等,为高频考点,把握物质的性质及混合物分离提纯方法等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.丙烯酸(CH2=CH-COOH)的性质可能有( )
①加成反应 ②水解反应③酯化反应 ④中和反应 ⑤氧化反应 ⑥加聚反应.
①加成反应 ②水解反应③酯化反应 ④中和反应 ⑤氧化反应 ⑥加聚反应.
| A. | ①③④ | B. | ①③④⑤⑥ | C. | ①③⑥ | D. | ①②③④⑤ |
1.下列说法正确的是( )
| A. | 除去Cu2+中的少量Fe3+,可加入CuO | |
| B. | 沸点:晶体硅>SiO2>SiCl4>NaCl | |
| C. | Cu(NH3)${\;}_{4}^{2+}$中的配位键是由Cu2+提供孤对电子,NH3提供空轨道形成的 | |
| D. | 石油的分馏、煤的液化以及煤的干馏等生产过程中均只发生物理变化 |
18.标准状况下将35mL气态烷烃完全燃烧,恢复到原来状况下,得到二氧化碳气体140mL,则该烃的分子式为( )
| A. | C5H12 | B. | C4H10 | C. | C3H6 | D. | C3H8 |
15.下列反应属于加成反应的是( )
| A. | 甲烷与氯气混合光照 | B. | 苯、浓硝酸和浓硫酸混合共热 | ||
| C. | 用乙醇销毁金属钠 | D. | 乙烯使溴的四氯化碳溶液褪色 |
2.市场上有些人不顾诚信与道德,用假货欺骗消费者.针对下面一些生活现象,某同学相应地提出了自己的观点,你认为错误的是( )
| A. | 某消费者购买了一件标识为含毛量100%的羊毛衫--可从毛衣上抽取丝毛点燃,根据能否产生烧焦蛋白质的特殊气味来初步判断是不是含有羊毛 | |
| B. | 某广告称某八宝粥(含桂圆、红豆、糯米等)未加糖,最适合糖尿病人食用--本广告有误导行为,不加糖不等于不含糖,糖尿病人食用需慎重 | |
| C. | 工业酒精勾兑的假酒伤人事件屡禁不止,某经营者称是由于消费者饮用过度导致--事实,甲醇、乙醇都是醇,甲醇更易醉死人,饮用工业酒精要适量 | |
| D. | 某公司称为了轻松“减肥”,可采用不运动、不节食、不忌口的快速瘦身药物疗法--不科学.多运动,可增加体内脂肪消耗;平衡膳食结构,少吃油腻食物,可防止脂肪在体内堆积过多 |
19.天然产物水有关解的叙述不正确的是( )
| A. | 油脂水解可得到丙三醇 | |
| B. | 可用碘检验淀粉是否发生水解 | |
| C. | 蛋白质水解的最终产物均为氨基酸 | |
| D. | 纤维素水解与淀粉水解得到的最终产物相同 |
20.工业合成氨与制备硝酸一般可连续生产,流程如图1:
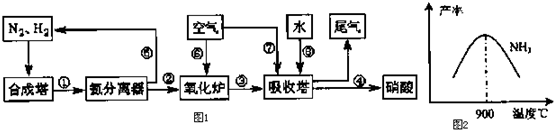
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1<300℃(填“>”、“<”或“=”).
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3的产率如图2所示.温度高于900℃时,
NH3产率下降的原因是温度高于900℃时,平衡向左移动.
(4)硝酸厂的尾气含有氮的氧化物,如果不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
(5)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:4NH3+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2N2+6H2O,科学家利用该反应的原理,设计成氨气--氧气燃料电池,则通入氨气的电极是:负极 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1<300℃(填“>”、“<”或“=”).
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
NH3产率下降的原因是温度高于900℃时,平衡向左移动.
(4)硝酸厂的尾气含有氮的氧化物,如果不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
(5)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:4NH3+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2N2+6H2O,科学家利用该反应的原理,设计成氨气--氧气燃料电池,则通入氨气的电极是:负极 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.