题目内容
15.上海作为2010年世博会的举办城市,公共交通的“绿色”也已经在进行.二甲醚(CH3OCH3)被称为21世纪的新型燃料,清洁、高效,有优良的环保性能,以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.有关说法正确的是( )| A. | 二甲醚与乙醇是同分异构体 | |
| B. | 该燃料电池中通入二甲醚的一极为正极 | |
| C. | 二甲醚作为汽车燃料不会产生氮的氧化物和碳氢化合物的污染 | |
| D. | 在燃料电池中二甲醚最终转化为CO2和H2O |
分析 该电池属于燃料电池,负极上燃料二甲醚失电子发生氧化反应,电极反应式为CH3OCH3+160H--12e-═2CO32-+11H2O,正极上氧气得电子发生还原反应,电极反应式为3O2+12e-+6H2O=12OH-,结合物质间的关系式解答.
解答 解:A.乙醇和二甲醚具有相同的分子式、不同结构,二者互为同分异构体,故A正确;
B.该燃料电池中,二甲醚失电子发生氧化反应,所以通入二甲醚的电极是负极,电极反应式为CH3OCH3+160H--12e-═2CO32-+11H2O,故B错误;
C.二甲醚属于有机物,燃烧生成二氧化碳和水,所以不产生氮的氧化物和碳氢化合物的污染,故C正确;
D.碱性电池中,二氧化碳能和氢氧根离子反应生成碳酸根离子,所以二甲醚最终转化为碳酸根离子和水,故D错误.
故选AC.
点评 本题考查了原电池原理,明确正负极上发生的电极反应式是解本题关键,注意电极反应式的书写要结合电解质溶液的酸碱性,题目难度不大.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
3.下列事实与氢键有关的是( )
| A. | 水加热到很高的温度都难以分解 | |
| B. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | 水结成冰体积膨胀 |
10.X、Y、Z、W、R五种短周期元素原子序数依次增大,X原子是最所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,其氢氧化物能溶于强碱溶液但不溶于氨水,W单质是人类将太阳能转变为电能的常用材料,下列相关说法正确的是( )
| A. | 原子半径按X、Y、Z、R、W的顺序一次增大 | |
| B. | WY2能与强碱溶液反应,但不能与任何酸反应 | |
| C. | Z与Y形成的化合物是碱性氧化物 | |
| D. | W的最高价氧化物对应的水化物难溶于水 |
20.工业合成氨与制备硝酸一般可连续生产,流程如图1:

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1<300℃(填“>”、“<”或“=”).
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3的产率如图2所示.温度高于900℃时,
NH3产率下降的原因是温度高于900℃时,平衡向左移动.
(4)硝酸厂的尾气含有氮的氧化物,如果不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
(5)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:4NH3+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2N2+6H2O,科学家利用该反应的原理,设计成氨气--氧气燃料电池,则通入氨气的电极是:负极 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1<300℃(填“>”、“<”或“=”).
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
NH3产率下降的原因是温度高于900℃时,平衡向左移动.
(4)硝酸厂的尾气含有氮的氧化物,如果不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
(5)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:4NH3+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2N2+6H2O,科学家利用该反应的原理,设计成氨气--氧气燃料电池,则通入氨气的电极是:负极 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
5.下列叙述合理的是( )
| A. | 苯、汽油、植物油和聚乙烯塑料都是碳氢化合物 | |
| B. | 葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体 | |
| C. | 水电站把机械能转化成电能,而核电站是把化学能转化成电能 | |
| D. | 糖类、油脂、蛋白质都是高分子化合物,都能发生水解反应 |
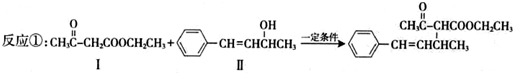
 .
.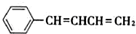 .
.