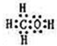题目内容
12.下列属于放热反应的是( )| A. | 铝和盐酸反应 | B. | 焦炭和二氧化碳共热 | ||
| C. | 石灰石的分解 | D. | 氢气还原氧化铜 |
分析 根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱),C或氢气做还原剂时的反应.
解答 解:A.铝和盐酸反应是放热反应,故A正确;
B.焦炭和二氧化碳共热是吸热反应,故B错误;
C.石灰石高温分解成氧化钙和二氧化碳的反应是吸热反应,故C错误;
D.氢气还原氧化铜反应是吸热反应,故D错误.
故选A.
点评 本题考查放热反应,难度不大,抓住中学化学中常见的吸热或放热的反应是解题的关键,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.

练习册系列答案
相关题目
2.市场上有些人不顾诚信与道德,用假货欺骗消费者.针对下面一些生活现象,某同学相应地提出了自己的观点,你认为错误的是( )
| A. | 某消费者购买了一件标识为含毛量100%的羊毛衫--可从毛衣上抽取丝毛点燃,根据能否产生烧焦蛋白质的特殊气味来初步判断是不是含有羊毛 | |
| B. | 某广告称某八宝粥(含桂圆、红豆、糯米等)未加糖,最适合糖尿病人食用--本广告有误导行为,不加糖不等于不含糖,糖尿病人食用需慎重 | |
| C. | 工业酒精勾兑的假酒伤人事件屡禁不止,某经营者称是由于消费者饮用过度导致--事实,甲醇、乙醇都是醇,甲醇更易醉死人,饮用工业酒精要适量 | |
| D. | 某公司称为了轻松“减肥”,可采用不运动、不节食、不忌口的快速瘦身药物疗法--不科学.多运动,可增加体内脂肪消耗;平衡膳食结构,少吃油腻食物,可防止脂肪在体内堆积过多 |
3.下列事实与氢键有关的是( )
| A. | 水加热到很高的温度都难以分解 | |
| B. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | 水结成冰体积膨胀 |
20.工业合成氨与制备硝酸一般可连续生产,流程如图1:

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1<300℃(填“>”、“<”或“=”).
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3的产率如图2所示.温度高于900℃时,
NH3产率下降的原因是温度高于900℃时,平衡向左移动.
(4)硝酸厂的尾气含有氮的氧化物,如果不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
(5)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:4NH3+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2N2+6H2O,科学家利用该反应的原理,设计成氨气--氧气燃料电池,则通入氨气的电极是:负极 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1<300℃(填“>”、“<”或“=”).
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
NH3产率下降的原因是温度高于900℃时,平衡向左移动.
(4)硝酸厂的尾气含有氮的氧化物,如果不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
(5)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:4NH3+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2N2+6H2O,科学家利用该反应的原理,设计成氨气--氧气燃料电池,则通入氨气的电极是:负极 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
1.下列说法正确的是( )
| A. | 将纤维素和硫酸加热水解后的液体取出少许,加入新制的Cu(OH)2悬浊液,并加热,若有红色沉淀生成,证明纤维素水解生成了葡萄糖 | |
| B. | 蛋白质溶液中加入甲醛可以使蛋白质从溶液中析出,加水又溶解 | |
| C. | 蔗糖和麦芽糖互为同分异物体,它们均能发生银镜反应 | |
| D. | 用甘氨酸(H2N-CH2-COOH)和丙氨酸(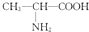 )缩合最多可形成4种二肽 )缩合最多可形成4种二肽 |
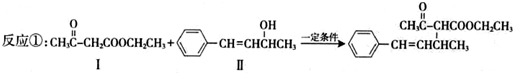
 .
.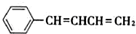 .
.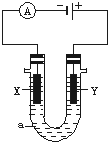 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: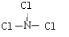 ;由A、B、D三种元素组成的18电子微粒的电子式为
;由A、B、D三种元素组成的18电子微粒的电子式为