题目内容
5.下列烃在光照下与氯气反应,只生成一种一氯代物的有( )| A. | 2-甲基丙烷 | B. | 异戊烷 | C. | 2,2-二甲基丁烷 | D. | 2,2-二甲基丙烷 |
分析 烃在光照下与氯气反应,只生成一种一氯代物,说明该烃分子中氢原子只有一种,据此进行判断.
解答 解:A.2-甲基丙烷的结构简式为:CH3CH(CH3)CH3,其分子中有2种等效氢原子,其一氯代物有2种,故A错误;
B.异戊烷的结构简式为:CH3CH2CH(CH3)2,其分子中含有4种等效氢原子,其一氯代物有4种,故B错误;
C.2,2-二甲基丁烷的结构简式为:CH3C(CH3)2CH2CH3,其分子中含有3种等效氢原子,其一氯代物有3种,故C错误
D.2,2-二甲基丙烷的结构简式为:CH3C(CH3)2CH3,其分子中所有H原子都完全等效,则其一氯代物只有1种,故D正确;
故选:D.
点评 本题考查了同分异构体的求算,题目难度中等,注意掌握同分异构体的概念及求算方法,明确烃中等效氢原子数目的求算方法为解答本题的关键.

练习册系列答案
相关题目
15.下列反应属于加成反应的是( )
| A. | 甲烷与氯气混合光照 | B. | 苯、浓硝酸和浓硫酸混合共热 | ||
| C. | 用乙醇销毁金属钠 | D. | 乙烯使溴的四氯化碳溶液褪色 |
16.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L | |
| B. | 0.1mol•L-1的NaHSO4溶液中含有阳离子的物质的量为0.2mol | |
| C. | 7.8 gNa2S和7.8 gNa2O2中含有的阴离子数目均为0.1 NA | |
| D. | l.8 g818O2分子与1.8 g818O3分子中含有的中子数不相同 |
13.下列关于有机物的说法不正确的是( )
| A. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| B. | 组成人体蛋白质的氨基酸有必须和非必须之分 | |
| C. | 乙醇和乙酸都是厨房中常用的调味品 | |
| D. | 淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖 |
20.工业合成氨与制备硝酸一般可连续生产,流程如图1:

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1<300℃(填“>”、“<”或“=”).
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3的产率如图2所示.温度高于900℃时,
NH3产率下降的原因是温度高于900℃时,平衡向左移动.
(4)硝酸厂的尾气含有氮的氧化物,如果不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
(5)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:4NH3+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2N2+6H2O,科学家利用该反应的原理,设计成氨气--氧气燃料电池,则通入氨气的电极是:负极 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1<300℃(填“>”、“<”或“=”).
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
NH3产率下降的原因是温度高于900℃时,平衡向左移动.
(4)硝酸厂的尾气含有氮的氧化物,如果不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
(5)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:4NH3+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2N2+6H2O,科学家利用该反应的原理,设计成氨气--氧气燃料电池,则通入氨气的电极是:负极 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
10.下列物质不能发生水解反应的是( )
| A. | 葡萄糖 | B. | 淀粉 | C. | 油脂 | D. | 蛋白质 |
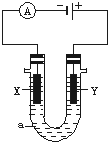 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: .
. .
.