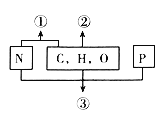
��Ŀ����
����Ŀ����ѧ�Ƽ������߶Ժ���̼���ʵĽ������ĸ�ʴ����Һ����ԵĹ�ϵ�������о�����25��ʱ�ó���ҺpHֵ�����ĸ�ʴӰ���ϵ��ͼ��ʾ,����˵����ȷ���ǣ� ��
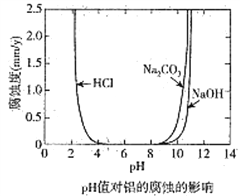
A. ��������Ũ�����еĸ�ʴ���ʴ��������еĸ�ʴ����
B. �����������Ի����в��ױ���ʴ
C. ��������pH=8.5��Na2CO3��Һ�лᷢ���绯ѧ��ʴ��������
D. �����õ��ķ����ڽ������ı����������ܵ������ﱡĤ
���𰸡�B
��������A����������Ũ�����в����ۻ�����ʴ����С�������еĸ�ʴ���ʣ���A����B����ͼ�п�֪����pH��4��8�������£��������������Ի����в��ױ���ʴ����B��ȷ��C�� ��������pH=8.5��Na2CO3��Һ�лᷢ���绯ѧ��ʴ������������ʧ���ӣ������������ϵõ��ӣ�������������C����D�����ص�������������ʱ����õ缫��Ӧ��������ʧ���ӵĹ��̣���2Al+3H2O-6e����Al2O3+6H�����������������ӵĵõ��ӹ��̣�������Һ�У�Ϊ6H��+6e����3H2�������õ��ķ����ڽ������ı����������ܵ������ﱡĤ����D����ѡB��

 ��������ϵ�д�
��������ϵ�д� ��ӡ�Ļ���ʱ����ϵ�д�
��ӡ�Ļ���ʱ����ϵ�д�����Ŀ��ijͬѧ��Ԫ�����ʵݱ����ʵ��ʱ�������һ��ʵ�鷽������¼���й�ʵ������
ʵ�鲽�� | ʵ������ |
�� ��þ����ɰֽ��ĥ�����Թ��У���������ˮ������ˮ���ڣ�������Һ�еμӷ�̪��Һ | A������ˮ���ϣ��۳�С���Ĵ��ζ���������˻˻��������֮��ʧ����Һ��ɺ�ɫ |
�ڽ�һС������Ʒ�����з�̪��Һ����ˮ�� | B���������������Һ���dz��ɫ |
�۽�þ��Ͷ��ϡ������ | C����Ӧ��ʮ�־��ң�������ɫ���� |
�ܽ�����Ͷ��ϡ������ | D�����ҷ�Ӧ��Ѹ�ٲ���������ɫ���� |
�������ͬѧ���������ʵ�鱨�档
��1��ʵ��Ŀ�ģ��о�_________________Ԫ�����ʵݱ���ɡ�
��2��ʵ�����ݣ�����д��ʵ�鲽���Ӧ��ʵ������ı�ţ�
ʵ������ | �� | �� | �� | �� |
ʵ��������A~D�� | _________ | ______ | _______ | ___________ |
��3��д��ʵ���\�ڶ�Ӧ��ѧ����ʽ
ʵ��� ______________________________________________________________________��
ʵ���_______________________________________________________________________��
��4��ʵ����ۣ�______________________________________________��