题目内容
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)Cu+在基态时的价电子排布式为__________________。
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能大于硒。请从原子结构的角度加以解释___________________________。
(3)GaAs熔点1238℃,难溶于溶剂。其晶体类型为_____________。
(4)AsF3的空间构型是:______________。
(5)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为________。
②[B(OH)4]-的结构式为____________________。
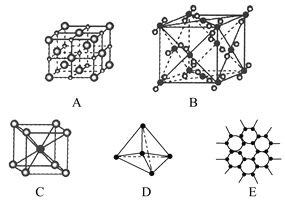
(6)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅:若将金刚石晶体中一半的碳原子換成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是_______________________(用化学式表示)。
②立方氮化硼(BN)晶体的结构与金刚石相似,硬度与金刚石相当,立方氮化硼的密度是ρ g·㎝-3,,则晶胞边长为___________。(只要求列算式,不必计算出数值,阿伏伽徳罗常数为NA)。
【答案】 3d10 砷的4p轨道上的电子处于半充满状态,比较稳定,气态原子失去一个电子需要的能量比较大原子晶体 原子晶体 三角锥形 sp3杂化 略 C>SiC>Si ![]()
![]()
【解析】(1)铜的原子序数为29,失去最外层一个电子形成Cu+,则Cu+在基态时的价电子排布式为:3d10。
(2)砷的价电子排布式4s24p3、硒的价电子排布式4s24p4,砷原子4p上电子是半充满,更加稳定,失电子困难,砷的第一电离能比硒的第一电离能大。
(3)GaAs熔点1238℃,难溶于溶剂,符合原子晶体的特性,故GaAs是原子晶体。
(4)由价层电子对互斥理论可知,n=(5+3)/2=4,As原子采取sp3杂化,而配原子(F)数为3,则AsF3的空间构型是:三角锥形 。
(5)① B是第二周期原子,只有s、p四个轨道,而[B(OH)4]-中有四个OH配体,则B原子采取sp3杂化。
② [B(OH)4]-的结构式为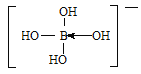 。
。
(6)①金刚石、晶体硅、碳化硅都是原子晶体,原子晶体中共价键的键能越大,晶体熔点越高,而键长越长键能越小,故金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是C>SiC>Si;②根据金刚石的结构可以判断出金刚石的一个晶胞中含有的碳原子数=8/8+6/2+4=8,因此一个立方氮化硼晶胞中含有4个N原子和4个B原子.一个晶胞中的质量为25g×4/ NA,密度=ZMr/NAa3(Z是晶胞含有的单位数,a为晶胞边长),ρ=25g×4/ NA a3,a=![]() pm。
pm。

【题目】下列实验、实验现象和相应结论都正确的是
实验 | 现象 | 结论 | |
A | 向1mL | 溶液分层,上层溶液显紫色。 | 氧化性:Fe3+>I2 |
B | 将两块表面积相等的Mg条和Al条放入同浓度同体积的NaOH溶液中。 | Al条产生气泡的速度快。 | 金属性:Al>Mg |
C | 向烧杯中加入一定体积蒸馏水,加热至沸腾时,向其中逐滴滴加饱和FeCl3溶液。 | 得到红褐色透明液体。 | 制得了氢氧化铁胶体。 |
D | 向盛有10 mL溴水的分液漏斗中加入10mL苯,振荡、静置。 | 溶液分为两层,上层为橙色。 | 溴在苯中的溶解能力大于水中。 |
A. A B. B C. C D. D