题目内容
【题目】硅、硼、铜、硒的单质及化合物在现代工业生产中有着广泛应用。回答下列问题:
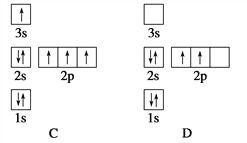
(1)基态Cu+的核外价层电子排布式为_______________;Be、B、Al的第一电离能由大到小的顺序是______________________________。
(2)硒、硅均能与氢元素形成气态氢化物,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se___ Si(填“>”、“<”)。
(3)SeO32-中Se原子的杂化类型为______,与其互为等电子体的一种分子的分子式是______________。
(4)CuSO4和Cu(NO3)2是自然界中重要的铜盐,向CuSO4熔液中加入过量稀氨水,产物的外界离子的空间构型为_________,Cu(NO3)2中的化学键除了σ键外,还存在_______________。
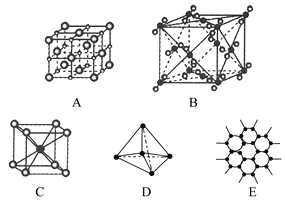
(5)磷化硼(BP)是一种耐磨材料,熔点高,其晶胞结构如图所示。该晶胞中B的堆积方式为___________,己知该晶体的晶胞参数a pm,用NA代表阿伏加德罗常数的值,则该晶体的密度为____ g·cm-3;构成晶体的两种粒子之间的最近距离为__________pm。

【答案】 3d10 Be> B>Al > sp3 NF3(或PF3、NCl3、PCl3等) 正四面体 离子键、π键 面心立方最密堆积 ![]()
![]()
【解析】(1)Cu的原子序数为29,核外电子数为29,Cu的核外电子排布式为[Ar]3d104s1,失去4s上的一个电子后,基态Cu+的核外价层电子排布式为3d10;Be和B处于同一周期,同一周期自左向右第一电离能有增大的趋势,但Be的4s能级处于全充满状态,稳定性强,故第一电离能Be>B,B和Al处于同一主族,同一主族自上而下第一电离能逐渐减小,即B>Al,所以第一电离能由大到小的顺序是Be>B>Al。本题答案为:3d10 ; Be>B>Al。
(2)“Si-H”中共用电子对偏向氢元素,说明非金属性H>Si,氢气与硒反应时单质硒是氧化剂,说明非金属性Se>H,即非金属性Se> Si,非金属性越强电负性越大,则硒与硅的电负性相对大小为Se>Si。
(3)SeO32-中Se原子孤对电子对数=![]() =1,σ键个数=3,所以为Se原子 sp3 杂化;SeO32-价电子总数为26,通过增减Se和O的电子数,进行判断,与其互为等电子体的一种分子的分子式可以是 NF3(或PF3、NCl3、PCl3等)。
=1,σ键个数=3,所以为Se原子 sp3 杂化;SeO32-价电子总数为26,通过增减Se和O的电子数,进行判断,与其互为等电子体的一种分子的分子式可以是 NF3(或PF3、NCl3、PCl3等)。
(4)SO42-中心原子的孤电子对数=![]() =0,含4个σ键,为sp3 杂化,空间构型为正四面体;Cu(NO3)2中的化学键除了σ键外,Cu2+与NO3-之间存在离子键,NO3-中存在π键。
=0,含4个σ键,为sp3 杂化,空间构型为正四面体;Cu(NO3)2中的化学键除了σ键外,Cu2+与NO3-之间存在离子键,NO3-中存在π键。
(5)从晶胞结构图看出,该晶胞中B的堆积方式为面心立方最密堆积;一个晶胞中B原子的数目=1(8个顶点)+3(6个面心)=4,P原子的数目=4(4个体心),1mol晶胞质量=(11+31)×4g=168g,1mol晶胞体积=(a×10-10)3NA,根据ρ=m/V,则该晶体的密度为![]() g·cm-3;仔细观察BP的晶胞结构不难发现,P位于BP晶胞中8个小立方体中互不相邻的4个小立方体的体心,B与P间的距离就是小立方体对角线的一半,即
g·cm-3;仔细观察BP的晶胞结构不难发现,P位于BP晶胞中8个小立方体中互不相邻的4个小立方体的体心,B与P间的距离就是小立方体对角线的一半,即![]() ×
×![]()
![]() pm。
pm。

 名校课堂系列答案
名校课堂系列答案【题目】磷酸铁锂是锂电池的电极材料,其成分为LiFePO4、 碳粉和铝箔。对该材料进行资源回收研究,设计实验流程如下:

已知:溶解度表:
Li2CO3 | LiOH | LiI | |
0℃ | l.54g | 12.7g | 151g |
100℃ | 0.72g | 13.6g | 179g |
回答下列问题:
(1)由滤液1到沉淀1反应的离子方程式为_______________________________。
(2)向滤渣1加入H2SO4、H2O2混合溶液时,磷酸铁锂溶解,反应的离子方程式为__________________________________。
(3)对滤渣1酸浸操作,下列实验条件控制正确的是(填字母代号) _________________。
a.加入H2O2溶液适当过量,有利于滤渣1的转化
b.适当提高硫酸溶液浓度并搅拌
c.用HNO3代替所加H2SO4和H2O2,节约药品更环保
(4)滤液2加氨水时,调节pH=3,此时溶液中c(Fe3+)=________ (常温下,Ksp[Fe(OH)3]=4.0×10-38)。
(5)向滤液3中加入物质X,根据溶解度表判断X可能是:___________ (填Na2CO3、NaOH或Nal)。
(6)对沉淀3进行洗涤操作,应选择________(选填“冷水”或“热水”)进行洗涤。
(7)磷酸铁锂电池的工作原理为:LiFePO4+ 6C![]() Li1-xFePO4 +LixC6,电池中的电解质可传导Li+。放电时正极的电极反应式为________________________________。
Li1-xFePO4 +LixC6,电池中的电解质可传导Li+。放电时正极的电极反应式为________________________________。
【题目】X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
Z | Z和Y同周期,Z的电负性大于Y |
W | W的一种核素的质量数为63,中子数为34 |
(1)Y位于元素周期表第________周期第________族,Y和Z的最高价氧化物对应的水化物的酸性较强的是________(写化学式)。
(2)W的基态原子核外电子排布式是___________________________________。
(3)W2Y在空气中煅烧生成W2O的化学方程式是________________________。