题目内容
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下:
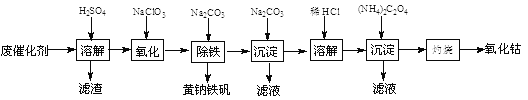
(1)溶解:溶解后过滤,将滤渣洗涤2~3次,滤渣的主要成分是________。(填化学式)
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式是________________。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]·3H2O。
3Fe2++ 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++ 3[Fe(CN)6 ]4- = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是__________________________________________。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式:______________________________________。
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2·3Co(OH)2],沉淀需洗涤,洗涤的操作是_______________________。
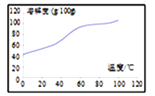
(5)溶解:CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是___________________________。
(6)三氧化铁是一种重要的化合物,可以用来腐蚀电路板。常温下,某腐蚀废液中含有0.5 molL-1 Fe3+ 和0.26 molL-1 Cu2+,欲使Fe3+完全沉淀[c(Fe3+)<4×10-5 molL-1时完全沉淀]而Cu2+不沉淀,则需控制溶液 pH的范围为_________________。 {KspCu(OH)2]=2.6×10-19 ;KspFe(OH)3]=4×10-38}
【答案】 SiO2 6Fe2++6H++C1O3-![]() 6Fe3++C1-+3H2O 取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化 3Fe2(SO4)3+6H2O+6N a2CO3=Na2Fe6(SO4)4(OH)12↓+5Na2SO4+ 6CO2↑ 沿玻璃棒向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出。重复操作2~3 次 防止因温度降低,CoCl2晶体析出 3≤pH<5
6Fe3++C1-+3H2O 取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化 3Fe2(SO4)3+6H2O+6N a2CO3=Na2Fe6(SO4)4(OH)12↓+5Na2SO4+ 6CO2↑ 沿玻璃棒向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出。重复操作2~3 次 防止因温度降低,CoCl2晶体析出 3≤pH<5
【解析】含钴废催化剂加入稀硫酸,发生Co+H2SO4=CoSO4+H2↑,Fe+H2SO4=FeSO4+H2↑,过滤滤渣是不溶的二氧化硅,而滤液是硫酸钴、硫酸亚铁与过量的硫酸的混合溶液,向滤液中加氯酸钠将亚铁离子氧化成铁离子,然后加入碳酸钠得到黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,继续向滤液中加入碳酸钠,得到碱式碳酸钴[(CoCO3)23Co(OH)2],然后用盐酸溶解碱式碳酸钴[(CoCO3)23Co(OH)2],再向所到溶液中加入草酸铵,得到溶解度极小的草酸钴,最后灼烧生成氧化钴。
(1)根据上述分析,溶解后过滤,将滤渣洗涤2~3次,滤渣的主要成分是SiO2,故答案为:SiO2;
(2)亚铁离子被氯酸根离子氧化成铁离子,1molr的亚铁离子失去1mol的电子,而1mol的氯酸根离子得到6mol的电子,根据电子得失守恒,可知离子方程式为:6Fe2++6H++ClO3-═6Fe3++Cl-+3H2O,取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化,故答案为:6Fe2++6H++ClO3-![]() 6Fe3++Cl-+3H2O;取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化;
6Fe3++Cl-+3H2O;取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化;
(3)生成硫酸铁与碳酸钠发生双水解得到黄钠铁矾,化学反应方程式为:3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6(SO4)4(OH)12↓+5Na2SO4+6CO2↑,故答案为:3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6(SO4)4(OH)12↓+5Na2SO4+6CO2↑;
(4)沉淀洗涤的方法是向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次,故答案为:向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次;
(5)CoCl2的溶解度曲线可知,随温度的升高,CoCl2的溶解度增大,所以趁热过滤,防止温度降低氯化钴析出,故答案为:防止因温度降低,CoCl2晶体析出;
(6)Fe3+完全沉淀时c(OH-)3=![]() =
=![]() (mol/L)3=1×10-33 (mol/L)3,此时c(OH-)=10-11 mol/L,pH=3;Cu2+沉淀时c(OH-)2=
(mol/L)3=1×10-33 (mol/L)3,此时c(OH-)=10-11 mol/L,pH=3;Cu2+沉淀时c(OH-)2=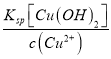 (mol/L)2=
(mol/L)2=![]() (mol/L)2=1×10-18 (mol/L)2,c(OH-)=10-9 mol/L,pH=5,所以控制溶液的pH范围为3≤pH<5,故答案为:3≤pH<5;
(mol/L)2=1×10-18 (mol/L)2,c(OH-)=10-9 mol/L,pH=5,所以控制溶液的pH范围为3≤pH<5,故答案为:3≤pH<5;