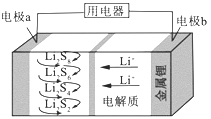
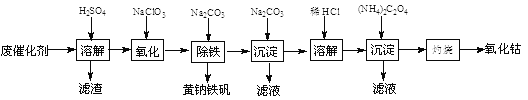
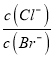题目内容
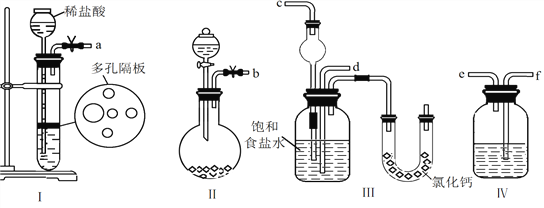
【题目】某化学实验小组设计下图装置制备氯气,图中涉及气体发生、除杂、干燥、收集及尾气处理装置。
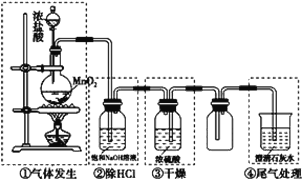
(1)上述装置中,错误的是____________(选填字母)。
A.①②④ B.①②③ C.①③④ D.②③④
(2)写出装置①中发生反应的化学方程式_____________________________________。该反应中,氧化剂是__________________。
(3)使0.15mol MnO2 与过量的12mol/L的浓盐酸反应,使50mL 12mol/L的浓盐酸与足量MnO2反应,两者产生的氯气相比(其他条件相同)____________(选填字母)。
A.一样多 B.前者较后者多
C.后者较前者多 D.无法比较
(4)将新制氯水滴到pH试纸上,有何现象?_________________________________。
(5)工业上用氯气生产漂白粉的化学反应方程式为______________________________。
【答案】D MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O MnO2 B 先变红后褪色 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
MnCl2+Cl2↑+2H2O MnO2 B 先变红后褪色 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】
根据氯气的实验室制法原理,分析评价实验装置和试剂选择的合理性。
(1)MnO2和浓HCl共热制氯气,使用固液加热发生装置,①正确。所得氯气中混有杂质HCl和H2O(g),除HCl应用饱和食盐水而不能用NaOH溶液,②错误。干燥氯气可用浓硫酸,但应进气导管长、出气导管短,③错误。除去尾气中的氯气,通常用NaOH溶液而不用石灰水,因Ca(OH)2溶解度较小,④错误。答案选D。
(2)装置①中发生反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。该反应中,MnO2得电子是氧化剂。
MnCl2+Cl2↑+2H2O。该反应中,MnO2得电子是氧化剂。
(3)制氯气反应中,HCl消耗和挥发,使盐酸浓度减小,而稀盐酸不能被MnO2氧化。0.15mol MnO2与过量的12mol/L浓盐酸反应时,MnO2能完全反应生成0.15mol Cl2。50mL 12mol/L的浓盐酸与足量MnO2反应时,会剩余MnO2和稀盐酸,参加反应的HCl小于0.6mol,生成 Cl2小于0.15mol。应选B。
(4)氯水是氯气的水溶液,其中存在三种分子:Cl2、H2O、HClO,四种离子:H+、Cl-、ClO-、OH-。因此,新制氯水滴到pH试纸上,先变红(氯水呈酸性)后褪色(次氯酸有漂白性)。
(5)工业上用氯气与石灰乳作用生产漂白粉,化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案