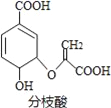
题目内容
【题目】某气态烃1mol跟2mol HCl加成,加成产物又可被8mol Cl2完全取代,该烃可能为( )
A.丁炔B.丙炔C.丙烯D.丁烯
【答案】A
【解析】
某气态烃1mol最多和2mol氯化氢发生加成反应,说明分子中含有1个C≡C或2个C=C键且碳原子数小于等于4,所得产物又能与8mol氯气发生取代反应,说明加成产物中含有8个H原子,则原气态烃应含有6个H原子,分子式为C4H6,所给四个选项中只有丁炔的分子式为C4H6。
答案为A。

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目