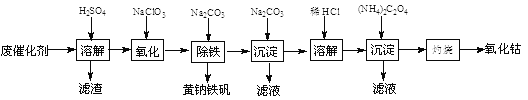
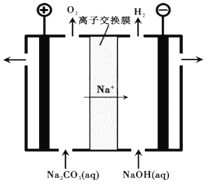
��Ŀ����
����Ŀ���ڻ���ƽ�����װ��ǿ��ԭ���£�N2H4����ǿ��������H2O2���������ǻ��ʱ��������������N2��ˮ���������ų������ȡ���֪0.4molҺ̬�º�����Һ̬H2O2��Ӧ�����ɵ�����ˮ������ �ų�256.64kJ��������
��1��д���÷�Ӧ���Ȼ�ѧ����ʽ
��2����֪H2O (l) = H2O(g) ��H= + 44 kJ��mol-1����16gҺ̬��ȼ�����ɵ�����Һ̬ˮʱ���ų������� kJ��
��3��������ӦӦ���ڻ���ƽ��������ͷŴ������ȺͿ��ٲ������������⣬����һ����ͻ���� �ŵ�
��4����֪N2(g)+2O2(g)=2 NO2(g) ��H= +68 kJ��mol-1�� N2H4(g)+O2(g)=N2(g)+2H2O(g) ��H=��534kJ��mol-1�����ݸ�˹����д������NO2��ȫ��Ӧ���ɵ�������̬ˮ���Ȼ�ѧ����ʽ
���𰸡���1��N2H4��1��+2H2O2��1��=N2��g��+4H2O��g����H=-641.625kJ/mol
��2��408.8 ��3������Ϊ������ˮ������Ⱦ
��4��2N2H4��g��+2 NO2 ��g���T3N2��g��+4 H2O��g������H=-1135.7kJ��mol-1��
��������
�����������1����֪0.4molҺ̬�º�����H2O2��l����Ӧ���ɵ�����ˮ����ʱ�ų�256.64kJ�������������Ȼ�ѧ����ʽ����дԭ��϶�����ϵд����1mol�º�����������Ӧ���ɵ�����ˮ�����ų�������=![]() =641.6KJ�������Ȼ�ѧ����ʽΪ��N2H4��1��+2H2O2��1��=N2��g��+4H2O��g����H=-641.625kJ/mol��
=641.6KJ�������Ȼ�ѧ����ʽΪ��N2H4��1��+2H2O2��1��=N2��g��+4H2O��g����H=-641.625kJ/mol��
��2��16gҺ̬�����ʵ���=![]() =0.5mol���ɢ�N2H4��1��+2H2O2��1��=N2��g��+4H2O��g������H=-641.6kJ/mol����H2O��1��=H2O��g����H=+44kJ/mol�������˹�����Ѣڡ�4����ת�õ���4H2O��g��=4H2O��l����H=-44��4kJ/mol=-176kJ/mol����+�۵�N2H4��1��+2H2O2��1��=N2��g��+4H2O��l������H=-817.6kJ/mol������0.5molҺ̬��������˫��ˮ��Ӧ���ɵ�����Һ̬ˮʱ���ų�������=
=0.5mol���ɢ�N2H4��1��+2H2O2��1��=N2��g��+4H2O��g������H=-641.6kJ/mol����H2O��1��=H2O��g����H=+44kJ/mol�������˹�����Ѣڡ�4����ת�õ���4H2O��g��=4H2O��l����H=-44��4kJ/mol=-176kJ/mol����+�۵�N2H4��1��+2H2O2��1��=N2��g��+4H2O��l������H=-817.6kJ/mol������0.5molҺ̬��������˫��ˮ��Ӧ���ɵ�����Һ̬ˮʱ���ų�������=![]() =408.8kJ����3����ӦӦ��������ƽ��������ͷų����������Ϳ������ɴ�����������������⣬��Ӧ���������ǵ�����ˮ����ͻ�����ŵ��ǶԻ�������Ⱦ����4������N2��g��+2O2��g���T2NO2��g������H=+67.7KJ��mol-1����N2H4��g��+O2��g���TN2��g��+2H2O ��g������H=-534KJ��mol-1
=408.8kJ����3����ӦӦ��������ƽ��������ͷų����������Ϳ������ɴ�����������������⣬��Ӧ���������ǵ�����ˮ����ͻ�����ŵ��ǶԻ�������Ⱦ����4������N2��g��+2O2��g���T2NO2��g������H=+67.7KJ��mol-1����N2H4��g��+O2��g���TN2��g��+2H2O ��g������H=-534KJ��mol-1
������ʽ2��-�ٵ�2N2H4��g��+2NO2��g��=3N2��g��+4H2O��g����H=2��-534KJ��mol-1��-��+67.7KJ��mol-1��=-1135.7kJ��mol-1��

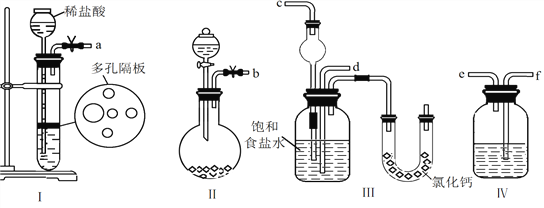
����Ŀ��ij��ѧ����С���������ͼ��ʾ��װ����ȡ����������ͼ�мг������ͼ���װ������ȥ������ش��������⣺

(1)ˮ�������ܵ�______���a����b���������롣
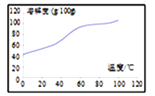
(2)��֪�������ݣ�
�Ҵ� | ���� | �������� | 98%Ũ���� | |
�۵�/�� | ��117.3 | 16.6 | ��83.6 | �� |
�е�/�� | 78.5 | 117.9 | 77.5 | 338.0 |
��֪�¶ȸ���140��ʱ��������Ӧ��2CH3CH2OH��CH3CH2OCH2CH3+H2O
�ٸø���Ӧ����__________��Ӧ������ĸ����
a���ӳ� b��ȡ�� c������
�ڿ��ǵ���Ӧ���ʵȶ������أ�������װ���Ʊ���������ʱ����Ӧ������¶ȷ�Χ��______������ĸ����
a��T��77.5�� b��T��150�� c��115�棼T��130��
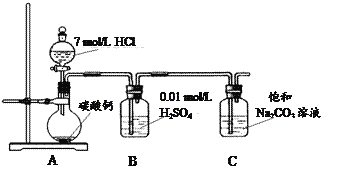
(3)����ʵ���б���̼������Һ�������ǣ�����ĸ����___________��
A���к�������Ҵ�
B���к����Ტ���ղ����Ҵ�
C�����������ڱ���̼������Һ�е��ܽ�ȱ���ˮ�и�С�������ڷֲ�����
D�������������ɣ���������
(4)�����������������Ӧʹ�õķ��뷽����__________��������������ƣ���ͬ�������õ�������Ϊ______ �� ���д˲������������л����е���Ҫ����������ˮ���ڲ�����ʹ�ø�����������£���ȥˮ����____________�ķ�����
(5)��ʵ��������������Ϊ6.0g���Ҵ�����Ϊ5.0g���õ������IJ�Ʒ����Ϊ4.4g�������������IJ�����_______��
(6)�Ҷ�����Ҷ���Ҳ�ܷ���������Ӧ��д�����ɻ����Ļ�ѧ��Ӧ����ʽ____________________��