题目内容
2.向AgNO3溶液中加入过量氨水,可生成[Ag(NH3)2]OH.下列说法正确的是( )| A. | 氨气极易溶于水,所得的氨水中存在3种不同的氢键 | |
| B. | [Ag(NH3)2]+ 中含有6个σ键 | |
| C. | [Ag(NH3)2]OH所含有的化学键有离子键、极性共价键和配位键 | |
| D. | 在[Ag(NH3)2]+离子中Ag+给出孤对电子,NH3提供空轨道 |
分析 A.N、O的电负性强,其氢化物易形成氢键;
B.N-H为σ键,配位键也为σ键;
C.[Ag(NH3)2]+与OH-形成离子键,N-H、O-H为极性共价键,且银离子提供空轨道、N原子提供孤对电子形成配位键;
D.Ag+提供空轨道,NH3提供孤对电子.
解答 解:A.NH3分子和H2O分子之间形成2种不同的氢键,故A错误;
B.N-H为σ键,配位键也为σ键,则[Ag(NH3)2]+ 中含有8个σ键,故A错误;
C.[Ag(NH3)2]+与OH-形成离子键,N-H、O-H为极性共价键,且银离子提供空轨道、N原子提供孤对电子形成配位键,则[Ag(NH3)2]OH所含有的化学键有离子键、极性共价键和配位键,故C正确;
D.Ag+提供空轨道,NH3提供孤对电子,形成配位键,故D错误;
故选C.
点评 本题考查化学键,为高频考点,把握化学键的形成及类型是为解答的关键,注意配位键为共价键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列晶体熔沸点由高到低的顺序正确的是( )
①SiC ②Si ③HCl ④HBr ⑤HI ⑥CO ⑦N2 ⑧H2.
①SiC ②Si ③HCl ④HBr ⑤HI ⑥CO ⑦N2 ⑧H2.
| A. | ①②③④⑤⑥⑦⑧ | B. | ①②⑤④③⑥⑦⑧ | C. | ①②⑤④③⑦⑥⑧ | D. | ⑥⑤④③②①⑦⑧ |
13.下列解释实验事实的反应方程式不正确的是( )
| A. | 盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O | |
| B. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗 4 Na+O2=2Na2O | |
| C. | 燃煤中加入石灰石可以减少SO2的排放:O2+2CaCO3+2SO2=2CO2+2CaSO4 | |
| D. | 酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH- |
10.某元素质量数51,中子数28,其基态原子未成对电子数为( )
| A. | 4 | B. | 1 | C. | 2 | D. | 3 |
17.下列变化或事实与范德华力无关的是( )
| A. | 气体物质加压或降温时能凝结或凝固 | |
| B. | 碘溶于四氯化碳 | |
| C. | 氟、氯、溴、碘单质的熔沸点依次升高 | |
| D. | 食盐熔化 |
7.下列关于可逆反应的叙述不正确的是( )
| A. | 某可逆反应达平衡状态时反应物和生成物共存 | |
| B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2+O2与2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O互为可逆反应 | |
| C. | 对于可逆反应,加入催化剂可使正逆反应速率均增大 | |
| D. | 提高可逆反应的限度可增加产量,从而提高经济效益 |
14. X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置如图.下列说法正确的是( )
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置如图.下列说法正确的是( )| A. | 五种元素中,原子半径最大的是W | |
| B. | Y的简单阴离子比W的简单阴离子还原性强 | |
| C. | Y与Z形成的化合物都可以和盐酸反应 | |
| D. | Q形成的含氧酸一定比W形成的含氧酸强 |
19.对于达到平衡状态的可逆反应:N2+3H2?2NH3,下列有关叙述正确的是( )
| A. | N2和NH3的质量分数相等 | B. | N2、H2、NH3的浓度之比为1:3:2 | ||
| C. | 反应物和生成物浓度不再发生变化 | D. | 正反应和逆反应不再进行 |

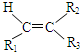 $→_{ⅱZn/H_{2}O}^{ⅰO_{3}}$ R1CHO+
$→_{ⅱZn/H_{2}O}^{ⅰO_{3}}$ R1CHO+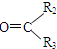
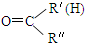 $\stackrel{一定条件下}{→}$ R-
$\stackrel{一定条件下}{→}$ R-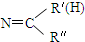 +H2O
+H2O .
.

 .
. .
.