��Ŀ����
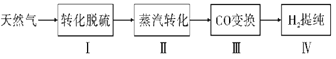
����Ŀ��������Ϊ�����Դ���Ź㷺��Ӧ��ǰ����������Ȼ���Ʊ�������������ͼ��
��ش��������⣺
I.ת��������Ȼ��ѹ����������30��ʱ����T��F�������£����Ի������������ʾ��ͼ���¡�

��1������i�����ӷ�Ӧ����ʽΪ__��
��2����֪��
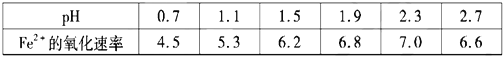
��Fe3+��pH=1.9ʱ��ʼ����pH=3.2ʱ������ȫ��
��30��ʱ����T��F�������£���ͬpH��FeSO4��Һ��Fe2+���������������
����˵����ȷ����___
A����ת�������У���ѵ�pH��Χ��1.5<pH<1.9
B����ת����������Ҫ���ϲ���Fe2(SO4)3
C����ת����������O2��ӵذ�H2S����ΪS
D����ת��������CH4��Ϊ��ԭ��������
��.����ת�����ڴ����������£�ˮ������CH4�����������ͼ�ش����⡣

��3���ٸù��̵��Ȼ�ѧ����ʽ��__��
�ڱȽ�ѹǿp1��p2�Ĵ�С��ϵ��p1__p2(ѡ����<������>������=��)��
��.CO�任��500��ʱ��CO��һ����ˮ��Ӧ����CO2��H2��
��.�ᴿ����CO2��H2����õ�H2�Ĺ���ʾ��ͼ��ͼ��
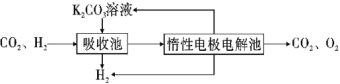
��4�����ճ��з�����Ӧ�����ӷ���ʽ��__��
���𰸡�2Fe3++H2S=2Fe2++S��+2H+ AC CH4(g)+H2O(g)=CO(g)+3H2(g) ��H=+204kJ/mol > CO2+H2O+CO32-=2HCO3-
��������
I��(1)���ⱻ�������������ɵ�����
(2)��ͼ������֪��1.5��pH��1.9����pH����1.9ʱ��Fe3+��ʼ����������Fe3+��Fe2+����Ũ�Ⱦ��½������ͷ�Ӧ���ʣ�pH��1.5ʱ��TF�����Խϵͣ�Fe2(SO4)3��ѭ�����ã�������Ӧ��ʵ�ʣ�O2��ӵذ�H2S����ΪS������ˮ��������CH4δ���뷴Ӧ��
����(3)���ڴ����������£�ˮ������CH4��������һ����̼��ˮ������ͼ�з�Ӧ���ʱ��H=2582KJ/mol-2378KJ/mol=204KJ/mol����ע���ʾۼ�״̬�Ͷ�Ӧ��Ӧ���ʱ�д���Ȼ�ѧ����ʽ��
��ͼ���м������������ѹǿ�������ݴ˷�����
����(4)������̼��̼�����Һ��Ӧ����̼����ء�
I�� (1)���ⱻ�������������ɵ�������i��H2S������������Ӧ�����ӷ���ʽ��2Fe3++H2S=2Fe2++S��+2H+���ʴ�Ϊ��2Fe3++H2S=2Fe2++S��+2H+��
(2) A. Fe3+��pH=l.9ʱ��ʼ������pH=3.2ʱ������ȫ������30��ʱ����T��F�������£���ͬpH��FeSO4��Һ��Fe2+���������ʿ�֪����ҵ����Ӧѡ������pH��Χ1.5��PH��1.9����PH����1.9ʱ��Fe3+��ʼ����������Fe3+��Fe2+����Ũ�Ⱦ��½������ͷ�Ӧ���ʣ�PH��1.5ʱ��TF�����Խϵͣ���Ӧ���ʼ�����A����ȷ��B. Fe2(SO4)3��ѭ�����ã�����Ҫ����Fe2(SO4)3��B�����C. ������Ӧ��ʵ�ʣ�O2��ӵذ�H2S����ΪS������ˮ�� C����ȷ��D. ������CH4δ���뷴Ӧ��D����ʴ�ѡAC��
(3)���ڴ����������£�ˮ������CH4��������һ����̼��ˮ������ͼ�з�Ӧ���ʱ��H=2582KJ/mol-2378KJ/mol=204KJ/mol����ע���ʾۼ�״̬�Ͷ�Ӧ��Ӧ���ʱ�д���Ȼ�ѧ����ʽΪ��CH4(g)+H2O(g)=CO(g)+3H2(g)��H=+204KJ/mol���ʴ�Ϊ��CH4(g)+H2O(g)=CO(g)+3H2(g)��H=+204KJ/mol��
�ڷ�Ӧǰ���������ʵ�����������ѹǿƽ��������У�ͼ���м������������ѹǿ��������ݴ˷������Ƚ�ѹǿP1��P2�Ĵ�С��ϵ��P1��P2���ʴ�Ϊ>��
����(4)�ٽ�CO2��H2����õ�H2�Ĺ���ʾ��ͼ�����õ���������̼��̼�����Һ��Ӧ����̼����أ���Ӧ�����ӷ���ʽΪCO2+H2O+CO32-=2HCO3-���ʴ�Ϊ��CO2+H2O+CO32-=2HCO3-��

 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�