лБд©дзхщ
║╬лБд©║©╪УиыNO2║╒SO2║╒CO╣хсп╨╕фЬлЕ╤т╢СфЬ╩╥╬Ё╣днё╨╕ё╛йгхкюЮ╣д╧╡м╛в╥гС║ё
ё╗1ё╘тзт╜вс╬╜╪ця╖т╜тРрЩ╣╪обё╛╩╞я╖╪рсцCOсКH2тз╪схх╪ся╧лУ╪Ч╨оЁиакр╨лЕх╪ао╪в╢╪ё╛фД╩╞я╖╥╢с╕╥╫Ёлй╫н╙__║ё
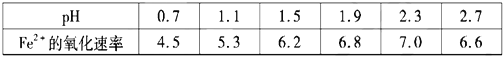
ё╗2ё╘рт╪в╢╪вЖх╪ао╣д╣ГЁьё╛хГм╪кЫй╬ё╛фД╦╨╪╚йг__ё╗лНa╩Рbё╘ё╛╦╨╪╚╣д╥╢с╕й╫н╙___ё╛уЩ╪╚╣д╥╢с╕й╫н╙___║ё╦цх╪ао╣ГЁьтзюМоКв╢л╛обё╛╫╚сп96.5%╣д╩╞я╖дэв╙╩╞Ёи╣Гдэё╛╪╢оШ╨д1molр╨лЕ╪в╢╪кЫдэ╡ЗиЗ╣двН╢С╣Гдэ╢О702.1kJё╛тРм╗Ёё╪в╢╪х╪иу╣дхх╩╞я╖╥╢с╕╥╫Ёлй╫н╙__║ё
ё╗3ё╘ряж╙ё╨NO2ё╗gё╘+SO2ё╗gё╘SO3ё╗gё╘+NOё╗gё╘ ║ВH=+41.8kJmol╘│1║ёр╩╤╗лУ╪Чобё╛╫╚NO2сКSO2ртлЕ╩Щ╠х1ё╨2жцсзцэ╠ухщфВжп╥╒иЗиойЖ╥╢с╕ё╛обапдэк╣цВ╥╢с╕╢О╣╫ф╫╨Бв╢л╛╣дйг___║ё
aё╝лЕо╣я╧г©╠ёЁж╡╩╠Д
bё╝╩Л╨офЬлЕяуи╚╠ёЁж╡╩╠Д
cё╝SO3╨мNO╣длЕ╩Щ╠х╠ёЁж╡╩╠Д
dё╝ц©оШ╨д1molSO3╣дм╛й╠иЗЁи1molNO2
╣╠иойЖ╥╢с╕ф╫╨Бй╠ё╛╡Б╣цNO2сКSO2лЕ╩Щ╠хн╙1ё╨6ё╛тРф╫╨БЁёйЩK=__║ё╣╠╦Ьря╢Оф╫╨Бв╢л╛╣диойЖ╥╢с╕иЩнбй╠ё╛ф╫╨БЁёйЩK║Д__║ёё╗╠Д╢С║╒╠Дп║╩Р╡╩╠Дё╘
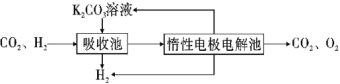
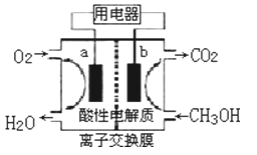
║╬╢П╟╦║©CO+2H2![]() CH3OH b CH3OH╘│6e-+H2O=CO2+6H+ O2+4H++4e-=2H2O CH3OHё╗lё╘+
CH3OH b CH3OH╘│6e-+H2O=CO2+6H+ O2+4H++4e-=2H2O CH3OHё╗lё╘+![]() O2ё╗gё╘=CO2ё╗gё╘+2H2Oё╗lё╘ ║ВH=╘│727.6kJ/mol b
O2ё╗gё╘=CO2ё╗gё╘+2H2Oё╗lё╘ ║ВH=╘│727.6kJ/mol b ![]() ╠Д╢С
╠Д╢С
║╬╫БнЖ║©
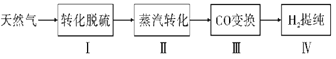
ё╗1ё╘╦Ы╬щCOсКH2тз╪схх╪ся╧лУ╪Ч╨оЁи╪в╢╪п╢ЁЖ╥╢с╕╥╫Ёлй╫ё╩
ё╗2ё╘х╪ао╣ГЁьжпм╗хКх╪ао╣др╩╪╚н╙╦╨╪╚ё╛╦╨╪╚иох╪аой╖╣Гвс╥╒иЗяУ╩╞╥╢с╕ё╛уЩ╪╚иояУ╩╞╪а╣ц╣Гвс╥╒иЗ╩╧т╜╥╢с╕ё╛╦цх╪ао╣ГЁь╣д╣Г╫Бжйхэр╨ЁйкАптё╛кЫрт╦╨╪╚ио╪в╢╪й╖╣Гвс╨мк╝╥╢с╕иЗЁи╤ЧяУ╩╞л╪╨мгБюКвсё╛яУфЬтзуЩ╪╚иоиЗЁик╝ё╩96.5%╣д╩╞я╖дэв╙╩╞Ёи╣Гдэё╛╪╢оШ╨д1molр╨лЕ╪в╢╪кЫдэ╡ЗиЗ╣двН╢С╣Гдэ╢О702.1kJё╛х╪иу1molр╨лЕ╪в╢╪╥еЁЖхха©н╙ё╨![]() ё╛х╩╨Сп╢ЁЖфДхх╩╞я╖╥╫Ёлй╫ё╩
ё╛х╩╨Сп╢ЁЖфДхх╩╞я╖╥╫Ёлй╫ё╩
ё╗3ё╘╢О╣╫ф╫╨Бв╢л╛й╠ё╛уЩдФ╥╢с╕кыбйоЮ╣хё╛╦ВнОжй╣де╗╤х╡╩╠Дё╛си╢кяэиЗ╣др╩п╘нОюМа©р╡╡╩╠Дё╛╪фкЦф╫╨Бй╠╦ВнОжй╣де╗╤хё╛©и╪фкЦф╫╨БЁёйЩё╛║ВHё╬0ё╛иЩ╦ънб╤хф╫╨БуЩрфё╛K╠Д╢С║ё
(1)╦Ы╬щCOсКH2тз╪схх╪ся╧лУ╪Ч╨оЁи╪в╢╪п╢ЁЖ╥╫Ёлн╙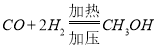
ё╛╧й╢П╟╦н╙ё╨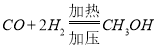 ё╩
ё╩
(2)х╪ао╣ГЁьжпм╗хКх╪ао╣др╩╪╚н╙╦╨╪╚ё╛╦╨╪╚иох╪аой╖╣Гвс╥╒иЗяУ╩╞╥╢с╕ё╛уЩ╪╚иояУ╩╞╪а╣ц╣Гвс╥╒иЗ╩╧т╜╥╢с╕ё╛╦цх╪ао╣ГЁь╣д╣Г╫Бжйхэр╨ЁйкАптё╛кЫрт╦╨╪╚ио╪в╢╪й╖╣Гвс╨мк╝╥╢с╕иЗЁи╤ЧяУ╩╞л╪╨мгБюКвсё╛рР╢к╦╨╪╚н╙bё╛╦╨╪╚╥╢с╕й╫н╙CH3OH-6e-+H2O=CO2+6H+ё╛яУфЬтзуЩ╪╚иоиЗЁик╝ё╛уЩ╪╚╣Г╪╚╥╢с╕й╫н╙ё╨O2+4e-+4H+╗T2H2Oё╩96.5%╣д╩╞я╖дэв╙╩╞Ёи╣Гдэё╛╪╢оШ╨д1molр╨лЕ╪в╢╪кЫдэ╡ЗиЗ╣двН╢С╣Гдэ╢О702.1kJё╛х╪иу1molр╨лЕ╪в╢╪╥еЁЖхха©н╙![]() ё╛фДхх╩╞я╖╥╫Ёлй╫н╙ё╨CH3OHё╗lё╘+
ё╛фДхх╩╞я╖╥╫Ёлй╫н╙ё╨CH3OHё╗lё╘+![]() O2ё╗gё╘=CO2ё╗gё╘+2H2Oё╗lё╘║ВH=╘│727.6kJ/molё╛╧й╢П╟╦н╙ё╨bё╩CH3OH-6e-+H2O=CO2+6H+ё╩CH3OHё╗lё╘+
O2ё╗gё╘=CO2ё╗gё╘+2H2Oё╗lё╘║ВH=╘│727.6kJ/molё╛╧й╢П╟╦н╙ё╨bё╩CH3OH-6e-+H2O=CO2+6H+ё╩CH3OHё╗lё╘+![]() O2ё╗gё╘=CO2ё╗gё╘+2H2Oё╗lё╘║ВH=╘│727.6kJ/molё╩
O2ё╗gё╘=CO2ё╗gё╘+2H2Oё╗lё╘║ВH=╘│727.6kJ/molё╩
(3)aё╝нчбшйг╥Я╢О╣╫ф╫╨Бё╛лЕо╣я╧г©╤╪╠ёЁж╡╩╠Дё╛╡╩дэсцсзеп╤ойг╥Я╢О╣╫ф╫╨Бв╢л╛ё╛╧йa╢МнСё╩
bё╝╩Л╨офЬлЕяуи╚╠ёЁж╡╩╠Дё╛к╣цВе╗╤х╡╩╠Дё╛╢О╣╫ф╫╨Бв╢л╛ё╛╧йbуЩх╥ё╩
cё╝SO3╨мNO╣д╪фа©йЩж╝╠хн╙1ё╨1ё╛нчбшйг╥Я╢О╣╫ф╫╨Бё╛╤Чуъ╣длЕ╩Щ╠х╠ёЁж╡╩╠Дё╛╡╩дэеп╤ойг╥Я╢О╣╫ф╫╨Бв╢л╛ё╛╧йc╢МнСё╩
dё╝нОжй╣да©ж╝╠х╣хсз╩╞я╖╪фа©йЩж╝╠хё╛тРц©оШ╨д1mol SO3╣дм╛й╠иЗЁи1molNO2ё╛╡╩дэеп╤ойг╥Я╢О╣╫ф╫╨Бв╢л╛ё╛╧йd╢МнСё╩
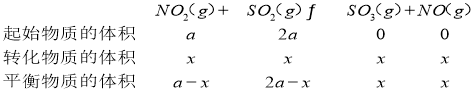 ё╛ф╫╨Бй╠NO2сКSO2лЕ╩Щ╠хн╙1ё╨6ё╛╪╢ё╗a-xё╘ё╨ё╗2a-xё╘=1ё╨6ё╛╧й
ё╛ф╫╨Бй╠NO2сКSO2лЕ╩Щ╠хн╙1ё╨6ё╛╪╢ё╗a-xё╘ё╨ё╗2a-xё╘=1ё╨6ё╛╧й![]() ё╛╧йф╫╨БЁёйЩ
ё╛╧йф╫╨БЁёйЩ![]() ё╛ряж╙║ВHё╬0ё╛иЩ╦ънб╤хф╫╨БуЩрфё╛K╠Д╢Сё╛╧й╢П╟╦н╙ё╨bё╩
ё╛ряж╙║ВHё╬0ё╛иЩ╦ънб╤хф╫╨БуЩрфё╛K╠Д╢Сё╛╧й╢П╟╦н╙ё╨bё╩![]() ё╩╠Д╢С║ё
ё╩╠Д╢С║ё

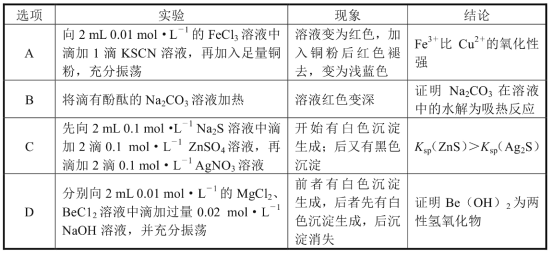
║╬лБд©║©сцхГм╪кЫй╬в╟жц╪ЛяИ╤тс╕фЬлЕй╠ё╛╡╩дэ╢О╣╫д©╣дйг

ё╗X║╙ЁЩтсв╟жц║╒Y║╙╪ЛяИв╟жцё╘
й╣яИд©╣д | йт╪аX | йт╪аY | |
A | ╪ЛяИДЕуТфШжп╩Лсп╣дNO2 | CCl4йт╪а | й╞хОйтр╨ |
B | ╪ЛяИHIжп╩Лсп╣дHCl | ╠╔╨мNaClхэр╨ | AgNO3хэр╨ |
C C | е╗янкАсКMnO2╧╡ххжфх║╣дбхфЬ | NaOHхэр╨ | ╣М╥шKIхэр╨ |
D | C2H5OHсКе╗H2SO4╪сххжа170║Фжфх║╣дрро╘ | NaOHхэр╨ | Br2╣дCCl4хэр╨ |
A.AB.BC.CD.D
║╬лБд©║©![]() ║╒
║╒![]() ╨м
╨м![]() тз╧╓р╣иЗ╡Зжпспжьр╙╣дс╕сц║ё
тз╧╓р╣иЗ╡Зжпспжьр╙╣дс╕сц║ё
ё╗1ё╘сц![]() ╢╕юМ╥офЬжп╣д
╢╕юМ╥офЬжп╣д![]() ╩АиЗЁи
╩АиЗЁи![]() ║╒
║╒![]() а╫жж╣╔жй║ётз╦ц╥╢с╕жпё╛яУ╩╞╪асК╩╧т╜╪а╣днОжй╣да©ж╝╠хн╙_________________________║ё
а╫жж╣╔жй║ётз╦ц╥╢с╕жпё╛яУ╩╞╪асК╩╧т╜╪а╣днОжй╣да©ж╝╠хн╙_________________________║ё
ё╗2ё╘юШсц![]() ©иоШЁЩ
©иоШЁЩ![]() ншх╬ё╛фД╥╢с╕н╙
ншх╬ё╛фД╥╢с╕н╙![]() ё╛╡╩м╛нб╤хобё╛оРв╟спвЦа©
ё╛╡╩м╛нб╤хобё╛оРв╟спвЦа©![]() ╧ллЕ╣д
╧ллЕ╣д![]() ╨Цхщцэ╠ухщфВжпм╗хК
╨Цхщцэ╠ухщфВжпм╗хК![]() ё╛╡Б╣ц
ё╛╡Б╣ц![]() фЬлЕ╣длЕ╩Щ╥жйЩ
фЬлЕ╣длЕ╩Щ╥жйЩ![]() кФй╠╪Д
кФй╠╪Д![]() ╣д╠Д╩╞гЗоъхГм╪кЫй╬║ё
╣д╠Д╩╞гЗоъхГм╪кЫй╬║ё

╒ынб╤хн╙T2й╠ё╛![]() дзё╛
дзё╛![]() ╣дф╫╬Ы╥╢с╕кыбй
╣дф╫╬Ы╥╢с╕кыбй![]() _____________________║ё
_____________________║ё
╒з╦ц╥╢с╕╣д![]() ________0ё╗лН║╟>║╠║╟<║╠╩Р║╟=║╠ё╘ё╛еп╤о╣дюМсийг_________________║ё
________0ё╗лН║╟>║╠║╟<║╠╩Р║╟=║╠ё╘ё╛еп╤о╣дюМсийг_________________║ё
ё╗3ё╘Ёёнбобё╛ряж╙![]() ╣д╣ГюКф╫╨БЁёйЩ
╣д╣ГюКф╫╨БЁёйЩ![]() ё╛
ё╛![]() ё╛м╗╧Щ╪фкЦ©и╣ц
ё╛м╗╧Щ╪фкЦ©и╣ц![]() ╣д
╣д![]() хэр╨
хэр╨![]() ___________║ё
___________║ё
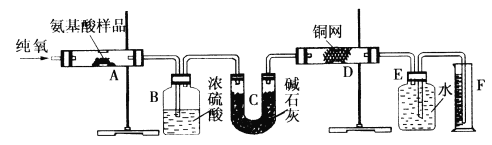
ё╗4ё╘н╙акх╥╤╗![]() яУ╩╞кыбй╥╫Ёлй╫
яУ╩╞кыбй╥╫Ёлй╫![]() жп
жп![]() ╣дж╣ё╗х║уШйЩё╘ё╛╫ЬппакоЮс╕й╣яИ║ё╣╠хэ╫Б
╣дж╣ё╗х║уШйЩё╘ё╛╫ЬппакоЮс╕й╣яИ║ё╣╠хэ╫Б![]() ╣де╗╤хн╙
╣де╗╤хн╙![]() й╠ё╛
й╠ё╛![]() сКкыбйё╗
сКкыбйё╗![]() ё╘йЩж╣╣д╧ьо╣хГоб╠МкЫй╬ё╛тР
ё╘йЩж╣╣д╧ьо╣хГоб╠МкЫй╬ё╛тР![]() _______║ё
_______║ё
| 3.65 | 7.30 | 10.95 | 14.60 |
| 10.2 | 40.80 | 91.80 | 163.20 |
ё╗5ё╘дЁ╧╓р╣╥ок╝жп╨╛сп![]() ║╒
║╒![]() ╣хюКвс║ёх║р╩╤╗а©╣д╦ц╧╓р╣╥ок╝ё╛оРфДжп╣н╪с
╣хюКвс║ёх║р╩╤╗а©╣д╦ц╧╓р╣╥ок╝ё╛оРфДжп╣н╪с![]() хэр╨ё╛╣╠
хэр╨ё╛╣╠![]() ©╙й╪Ёа╣Мй╠ё╛хэр╨жп
©╙й╪Ёа╣Мй╠ё╛хэр╨жп _______ё╗╠ёаТа╫н╩спп╖йЩвжё╘║ёё╗ряж╙ё╨25║Фй╠ё╛
_______ё╗╠ёаТа╫н╩спп╖йЩвжё╘║ёё╗ряж╙ё╨25║Фй╠ё╛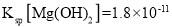 ё╛
ё╛![]() ё╘
ё╘
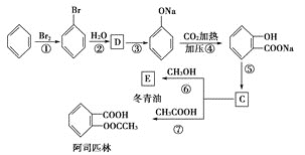
║╬лБд©║©обапнр╧З©фяпЁи╧ШкЫиФ╪╟╡даожпё╛жВр╙Ёи╥жн╙м╛жВвЕт╙кьпнЁи╣днч╩З╥г╫ПйТ╡дао╣дйг
|
|
|
|
Aё╝4.03цв╢С©з╬╤л╪╩╞╧Х╥╢иД╬╣ | Bё╝2022дЙ╤╛╟б╩А╬ш╟╠У╔кы╩╛╥Ч | Cё╝дэфа╠н╣Г╢е╡╗╣дл╪╟Э╦╡рЬдицвоъ | Dё╝║╟сЯмц╤Ч╨е║╠Ня╨о╫Пи╦мЬбж |
A. AB. BC. CD. D