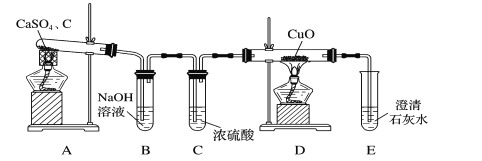
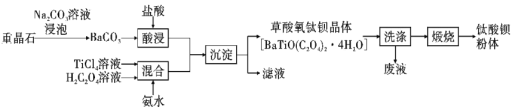
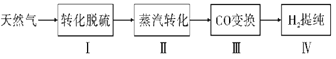
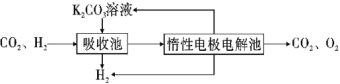
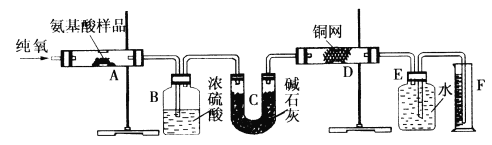
题目内容
【题目】硼酸(H3BO3)为弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是( )

A.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
B.反应一段时间以后,阴极室NaOH溶液浓度增大,阳极室H2SO4浓度增大
C.当电路中通过3mol电子时,可得到1molH3BO3
D.电解过程中,B(OH)4-穿过阴膜进入产品窒,Na+穿过阳膜进入阴极室
【答案】C
【解析】
A. 电解时阳极a上H2O失电子生成O2和H+,电极反应式为2H2O4e=O2↑+4H+,A项正确;
B. 阴极电极反应式为4H2O+4e=2H2↑+4OH,阳极电极反应式为2H2O4e=O2↑+4H+反应一段时间以后,阴极室NaOH溶液浓度增大,阳极室H2SO4浓度增大,B项正确;
C. 阳极电极反应式为2H2O4e=O2↑+4H+,电路中通过3mol电子时有3molH+生成,硼酸(H3BO3) 为一元弱酸,生成1mol硼酸需要1molH+,所以电路中通过3mol电子时,可得到3molH3BO3,C项错误;
D. 阳极电极反应式为2H2O4e=O2↑+4H+、阴极电极反应式为4H2O+4e=2H2↑+4OH,阳极室中的氢离子穿过阳膜进入产品室,原料室中Na+穿过阳膜进入阴极室,B(OH)4-穿过阴膜进入产品室,D项正确;
答案选C。

 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案【题目】![]() 、
、![]() 和
和![]() 在工业生产中有重要的应用。
在工业生产中有重要的应用。
(1)用![]() 处理废气中的
处理废气中的![]() 会生成
会生成![]() 、
、![]() 两种单质。在该反应中,氧化剂与还原剂的物质的量之比为_________________________。
两种单质。在该反应中,氧化剂与还原剂的物质的量之比为_________________________。
(2)利用![]() 可消除
可消除![]() 污染,其反应为
污染,其反应为![]() ,不同温度下,向装有足量
,不同温度下,向装有足量![]() 固体的
固体的![]() 恒容密闭容器中通入
恒容密闭容器中通入![]() ,测得
,测得![]() 气体的体积分数
气体的体积分数![]() 随时间
随时间![]() 的变化曲线如图所示。
的变化曲线如图所示。

①温度为T2时,![]() 内,
内,![]() 的平均反应速率
的平均反应速率![]() _____________________。
_____________________。
②该反应的![]() ________0(填“>”“<”或“=”),判断的理由是_________________。
________0(填“>”“<”或“=”),判断的理由是_________________。
(3)常温下,已知![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() ,通过计算可得
,通过计算可得![]() 的
的![]() 溶液
溶液![]() ___________。
___________。
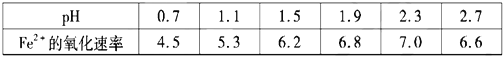
(4)为了确定![]() 氧化速率方程式
氧化速率方程式![]() 中
中![]() 的值(取整数),进行了相应实验。当溶解
的值(取整数),进行了相应实验。当溶解![]() 的浓度为
的浓度为![]() 时,
时,![]() 与速率(
与速率(![]() )数值的关系如下表所示,则
)数值的关系如下表所示,则![]() _______。
_______。
| 3.65 | 7.30 | 10.95 | 14.60 |
| 10.2 | 40.80 | 91.80 | 163.20 |
(5)某工业废水中含有![]() 、
、![]() 等离子。取一定量的该工业废水,向其中滴加
等离子。取一定量的该工业废水,向其中滴加![]() 溶液,当
溶液,当![]() 开始沉淀时,溶液中
开始沉淀时,溶液中 _______(保留两位有效数字)。(已知:25℃时,
_______(保留两位有效数字)。(已知:25℃时,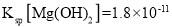 ,
,![]() )
)