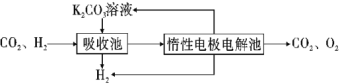
题目内容
【题目】已知:
CH3CH2CH2+HCl![]() CH3CH2CH3 +Cl
CH3CH2CH3 +Cl![]() CH(CH3)2 + HCl
CH(CH3)2 + HCl
CH3CH2CH2+ HBr![]() CH3CH2CH3+Br
CH3CH2CH3+Br![]() CH(CH3)2+HBr
CH(CH3)2+HBr
下列说法正确的是( )
A.ΔH1=ΔH2+ΔH3-ΔH4
B.HCl和HBr的键能差可以表示为ΔH1-ΔH3
C.ΔH2>ΔH4
D.升温时,丙烷与Cl反应速率加快,与Br反应速率降低
【答案】A
【解析】
A、①ΔH2 CH3CH2CH3 +Cl→CH(CH3)2 + HCl ΔH2
②CH3CH2CH3+Br→CH3CH2CH2+ HBr ΔH3
③CH3CH2CH3+Br→CH(CH3)2+HBr ΔH4
根据盖斯定律①+②-③得CH3CH2CH3 +Cl→CH3CH2CH2+HCl ΔH1=ΔH2+ΔH3-ΔH4,故A正确;
B、根据焓变=反应物的总键能-生成物的总键能,HCl和HBr的键能差可以表示为ΔH3-ΔH1,故B错误;
C、焓变=反应物的总键能-生成物的总键能,HCl的键能大于HBr,所以ΔH2<ΔH4,故C错误;
D、升温时,反应速率加快,所以升高温度丙烷与Cl反应速率、丙烷与Br反应速率均加快,故D错误。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
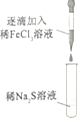
小学生10分钟应用题系列答案【题目】某小组同学探究铁离子与硫离子的反应,实验操作及现象如表:下列有关说法错误的( )
| 滴入FeCl3溶液立刻有黑色沉淀生成继续滴入FeC13溶液,黑色沉淀增多后又逐渐转化为黄色沉淀 |
| 滴入Na2S溶液立刻生成黑色沉淀,沉淀下沉逐渐转化为黄色。继续滴入Na2S溶液,最后出现黑色的沉淀 |
A.两次实验中,开始产生的黑色沉淀都为Fe2S3
B.两次实验中,产生的黄色沉淀是因为发生了反应Fe2S3+4FeCl3═6FeCl2+3S
C.向稀FeCl3溶液中逐滴加入稀Na2S溶液至过量最后生成的黑色沉淀为FeS
D.在Na2S溶液过量的情况下,黑色沉淀中存在较多的Fe(OH)3
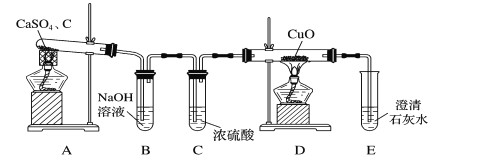
【题目】用如图所示装置检验对应气体时,不能达到目的是
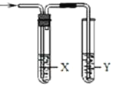
(X—除杂装置、Y—检验装置)
实验目的 | 试剂X | 试剂Y | |
A | 检验溴蒸汽中混有的NO2 | CCl4试剂 | 石蕊试液 |
B | 检验HI中混有的HCl | 饱和NaCl溶液 | AgNO3溶液 |
C C | 浓盐酸与MnO2共热制取的氯气 | NaOH溶液 | 淀粉KI溶液 |
D | C2H5OH与浓H2SO4加热至170℃制取的乙烯 | NaOH溶液 | Br2的CCl4溶液 |
A.AB.BC.CD.D
【题目】(1)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4 kJ/mol,其化学平衡常数K与温度t的关系如下表:
2NH3(g)△H=-92.4 kJ/mol,其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | ...... |
K/(mol/L)2 | 4.1×106 | K1 | K2 | ...... |
完成下列问题:
①比较K1、K2的大小:K1_______K2(填“>”、“=”或“<”);
②在恒温恒压下判断该反应达到化学平衡状态的依据是_______(填序号);
A 2v(H2)(正)=3v(NH3)(逆)
B 2v(N2)(正)=v(H2)(逆)
C 容器内压强保持不变
D 混合气体的密度保持不变
(2)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6molNH3和3molCO2,反应达到平衡时,c(NH3)=0.5mol·L-1,则该反应的平衡常数K=_______。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的v正_______v逆(填“>”“<”或“=”)。
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6molNH3和3molCO2,反应达到平衡时,c(NH3)=0.5mol·L-1,则该反应的平衡常数K=_______。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的v正_______v逆(填“>”“<”或“=”)。
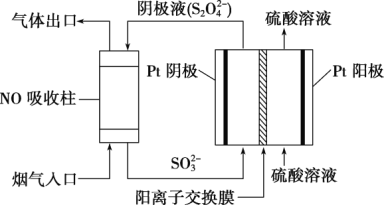
(3)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。
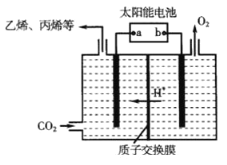
①该工艺中能量转化方式主要有_______。
②电解时,生成乙烯的电极反应式是_______。