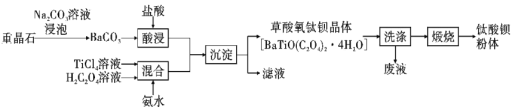
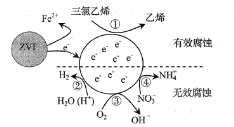
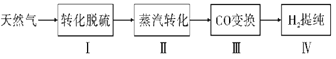
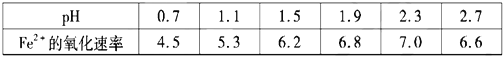
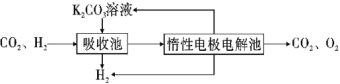
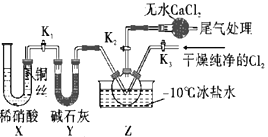
题目内容
【题目】在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=﹣akJmol﹣1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
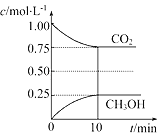
(1)能说明该反应已达平衡状态的是________(填编号)。
A.单位时间内每消耗1.2mol H2,同时生成0.4mol H2O
B.CO2的体积分数在混合气体中保持不变
C.混合气体的平均相对分子质量不随时间的变化而变化
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
(2)若要使K=1,则改变的条件可以是________(填选项)。
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加入催化剂。
【答案】BC D
【解析】
(1)①平衡状态可以根据两个方两去判断,一、是看正逆反应速是否相等,二是各组分的浓度是否随时间的改变而改变;也可以抓住变量不变来解分析;
(2)先计算该温度下此反应的平衡常数,根据平衡常数只与温度有关,分析若使该反应K=l需要改变的条件。
(1)①A.单位时间内每消耗1.2mol H2,同时生成0.4mol H2O,不能反映正逆反应速率之间的关系,故不选A错误;
B.反应过程中CO2的体积分数是个变化的量,现在混合气体CO2的体积分数保持不变,说明已经平衡了,故选B;
C.根据 ,反应过程中,混合气体的平均相对分子质量是个变化的量,现在不随时间的变化而变化,说明已经达平衡状态,故选C;
,反应过程中,混合气体的平均相对分子质量是个变化的量,现在不随时间的变化而变化,说明已经达平衡状态,故选C;
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变,不能说明各自的浓度不再随时间的变化而变化,故不选D。
(2) 通入2mol CO2和3mol H2,根据图示,

![]() 0.20,
0.20,
平衡常数是温度的函数,只有通过改变温度来改变平衡常数,正反应量放热反应,降低温度,K值变大,若要使K=1,则改变的条件可以是降温,选D。