题目内容
1.已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-12CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
| A. | H2(g)的燃烧热为571.6 kJ•mol-1 | |
| B. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol-1 |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B、反应生成硫酸钡沉淀过程是放热过程;
C、根据热化学方程式计算热量;
D、根据已知热化学方程式,结合盖斯定律计算.
解答 解:A.燃烧热是指1mol纯物质完全燃烧生成稳定的氧化物所放出的热量,所以H2的燃烧热为$\frac{1}{2}$×571.6 KJ/mol,故A错误;
B.中和热是强酸强碱的稀溶液完全反应生成1mol水时放出的热量,反应生成硫酸钡沉淀过程是放热过程,△H<-57.3 kJ•mol-1,故B错误;
C.令H2(g)和CH3OH(l)的质量都为1g,则1g氢气燃烧放热为$\frac{1}{2}$×$\frac{1}{2}$×571.6=142.45KJ,1gCH3OH燃烧放热为$\frac{1}{32}$×$\frac{1}{2}$×1452=22.68KJ,所以H2(g)放出的热量多,故C正确;
D.2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1改写为3H2(g)+$\frac{3}{2}$O2(g)═3H2O(l)△H=-($\frac{3}{2}$×571.6)kJ•mol-1,
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1改写为CO2(g)+2H2O(l)=CH3OH(l)+$\frac{3}{2}$O2(g))△H=+($\frac{1}{2}$×1452)kJ•mol-1.
改写后的方程相加即得3H2(g)+CO2(g)=CH3OH(l)+H2O(l),所以其△H═-($\frac{3}{2}$×571.6)+($\frac{1}{2}$×1452)=-131.4kJ•mol-1.故D错误.
故选C.
点评 本题考查了反应燃烧热、中和热概念的分析应用,盖斯定律的应用,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 使用催化剂可以增大正反应速率,减小逆反应速率 | |
| B. | 使用催化剂可以使化学平衡正向移动 | |
| C. | 使用催化剂可以降低反应的活化能 | |
| D. | 使用催化剂可以改变反应的平衡常数 |
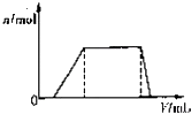 1L某混合溶液,可能含有的离子如下表:
1L某混合溶液,可能含有的离子如下表:| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
海水在浓缩过程中析出盐的种类和质量(单位g/L)
| 海水密度 | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
a.NaCl的浓度 b.海水的密度 c.盐类的溶解度 d.MgCl2的溶解度
(2)当海水密度达到1.13g/mL时,首先析出的盐是CaSO4,主要原因是a(选填编号).
a.CaSO4的溶解度最小 b.CaSO4的浓度最小 c.CaSO4的含量最高 d.CaSO4的溶解度最大
(3)为了使粗盐中除氯化钠外,含杂质较少,实际生产中卤水的密度控制的范围是1.21~1.26g/mL
(4)粗盐中所含的杂质离子有Mg2+、SO42-、Ca2+,现用BaCl2、NaOH、Na2CO3、HCl精制食盐水,其试剂的滴加顺序是BaCl2、NaOH、Na2CO3、HCl或NaOH、BaCl2、Na2CO3、HCl.
(5)食盐是重要的化工原料,写出电解饱和食盐水的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑; 阳极的产物是Cl2,检验的方法是使湿润的碘化钾淀粉试纸变蓝.工业上将该产物与消石灰反应制得漂粉精,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.将电解产物氢气和氯气结合,生成氯化氢,溶于水即得盐酸,写出盐酸的电离方程式HCl=H++Cl-.
(6)在实验室用加热食盐浓硫酸的方法来制取氯化氢气体,写出在微热条件下反应的化学方程式NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑.制得的氯化氢气体可做“喷泉”实验,利用同样的装置再举出一组可形成“喷泉”的气体与液体NH3和H2O.
(1)请根据实验现象,将你作出的判断填在表格内的相应位置.
| 步骤序号 | 操作 | 实验现象 | 判 断 |
| ① | 取固体溶于水,得溶液X | 得到无色溶液 | |
| ② | 取少量溶液X,加入氯化钡溶液 | 生成白色沉淀 | 可能含有SO42-、SO32-、CO32- (填离子符号) |
| ③ | 取少量溶液X,加入浓氢氧化钠溶液,加热,并在试管口用湿润的红色石蕊试纸检验 | 试纸变蓝 | 含有NH4+ (填离子符号) |
| 结论:此白色固体可能是(NH4)2SO4或(NH4)2SO3或(NH4)2CO3. | |||
(3)在此实验中所使用仪器为普通玻璃,其组成可以用氧化物的形式来表示:Na2O•CaO•6SiO2,制造这种玻璃的原料是石灰石、纯碱和石英.若每天要生产10t玻璃,石灰石的利用率为80%计算,纯碱和石英的利用率按95%计算,每天至少需要纯碱和石灰石的质量是多少?(写出计算过程,计算结果保留两位有效数字)
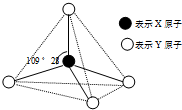 现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.请回答下列问题:
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.请回答下列问题: