题目内容
11.有一包白色固体(一种二元酸的正盐),下表为进行相关实验的部分实验报告.(1)请根据实验现象,将你作出的判断填在表格内的相应位置.
| 步骤序号 | 操作 | 实验现象 | 判 断 |
| ① | 取固体溶于水,得溶液X | 得到无色溶液 | |
| ② | 取少量溶液X,加入氯化钡溶液 | 生成白色沉淀 | 可能含有SO42-、SO32-、CO32- (填离子符号) |
| ③ | 取少量溶液X,加入浓氢氧化钠溶液,加热,并在试管口用湿润的红色石蕊试纸检验 | 试纸变蓝 | 含有NH4+ (填离子符号) |
| 结论:此白色固体可能是(NH4)2SO4或(NH4)2SO3或(NH4)2CO3. | |||
(3)在此实验中所使用仪器为普通玻璃,其组成可以用氧化物的形式来表示:Na2O•CaO•6SiO2,制造这种玻璃的原料是石灰石、纯碱和石英.若每天要生产10t玻璃,石灰石的利用率为80%计算,纯碱和石英的利用率按95%计算,每天至少需要纯碱和石灰石的质量是多少?(写出计算过程,计算结果保留两位有效数字)
分析 (1)②加入氯化钡溶液生成沉淀,可能含有SO42-、SO32-、CO32-离子;
③根据铵离子的检验方法进行判断;
根据以上分析可以推测出白色固体成分;
(2)在②中加入盐酸,根据现象判断物质组成;
(3))根据CaCO3-CaO,Na2CO3-Na2O,计算即可,注意原料要乘以利用率.
解答 解:(1)②由于加入氯化钡溶液生成沉淀,可能含有SO42-、SO32-、CO32-离子,
故答案为:SO42-、SO32-、CO32-;
③加入浓氢氧化钠溶液,加热,并在试管口用湿润的红色石蕊试纸检验,试纸变蓝,证明含有铵离子,
故答案为:NH4+;
根据以上分析,白色固体可能为:(NH4)2SO4或(NH4)2SO3或(NH4)2CO3
故答案为:(NH4)2SO4或(NH4)2SO3或(NH4)2CO3;
(2)想进一步确认此白色固体的成分,需要在步骤②加入盐酸进行检验,
故答案为:②;盐酸;
(3)每天10t,其中含有Na2O质量10t×13%=1.3t,CaO质量10t×11.7%=1.17t,SiO2质量10t×75.3%=7.53t,而Na2O都是从Na2CO3中来,CaO都是从CaCO3中来,
SiO2都是从石英中来,根据质量守恒可知设需要石灰石CaCO3质量x,纯碱Na2CO3质量y,
则:80%×x×$\frac{56}{100}$=1.17t,解得x≈2.6t;95%×y×$\frac{62}{106}$=1.3t,解得:y≈2.4t,
答:每天至少需要纯碱2.6t、纯碱2.4t.
点评 本题考查了未知物的检验及化学计算,题目难度中等,明确常见物质的性质及检验方法为解答关键,注意掌握质量守恒定律在化学计算中的应用方法,试题培养了学生的分析能力及化学实验、化学计算能力.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案
相关题目
1.已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
| A. | H2(g)的燃烧热为571.6 kJ•mol-1 | |
| B. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol-1 |
2.下列说法中错误的是( )
| A. | 化学反应必然伴随发生能量变化 | |
| B. | 化学反应中能量变化的大小与反应物的状态有关 | |
| C. | 化学变化中的能量变化全部是由化学键变化引起的 | |
| D. | 能量变化是化学反应的基本特征之一 |
19.下列实验能成功的是( )
| A. | 氯乙烷与NaOH溶液共热,在水解后的溶液中加入硫酸,再加入AgNO3溶液检验Cl- | |
| B. | 将电石和水反应后的气体通入溴水中,如果溴水褪色,证明乙炔和溴发生了反应 | |
| C. | 实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中 | |
| D. | 向苯酚浓溶液中滴入少量浓溴水可观察到白色三溴苯酚沉淀 |
3.能与Na反应放出H2,又能是溴水褪色,但不能使石蕊试纸变红色的物质是( )
| A. | CH3-CH2-COOH | B. | CH2=CH-CH2-OH | C. | CH2=CH-COOH | D. | CH2=CH-COOCH3 |
20.下列有关物质性质的说法错误的是( )
| A. | 热稳定性:HCl>HI | B. | 原子半径:Na>Mg | ||
| C. | 酸性:H2SO4>H2SO3 | D. | 结合质子能力:Cl->S2- |
1.国家发改委、中宣部等十七部委在人民大会堂举行“节能减排全民行动”启动仪式,要求在全国范围内形成全民节能减排氛围.下列有关做法不符合这一要求的是( )
| A. | 在水力发电、火力发电、核能发电和风力发电中,要大力发展火力发电 | |
| B. | 在汽车上安装汽车尾气催化转化装置,使之发生如下反应:2CO+2NO═2CO2+N2 | |
| C. | 在大力推广乙醇汽油的同时,研究开发太阳能汽车和氢燃料电池汽车 | |
| D. | 将煤液化、气化,提高燃料的燃烧效率 |
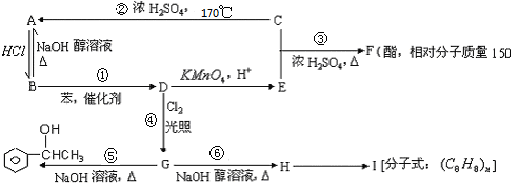
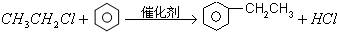
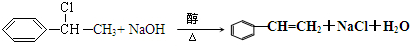
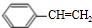 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$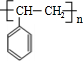 .
.

 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$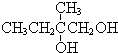 +2NaBr,反应类型取代反应
+2NaBr,反应类型取代反应 +O2+O2$\stackrel{催化剂}{→}$2
+O2+O2$\stackrel{催化剂}{→}$2 +2H2O,反应类型氧化反应
+2H2O,反应类型氧化反应 、
、 .
.