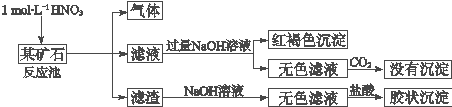
题目内容
9.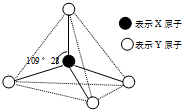 现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.请回答下列问题:
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.请回答下列问题:(1)写出单质A的同素异形体与B物质发生置换反应的化学方程式SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;同主族的第四周期元素基态原子的外围电子排布式为4s24p2.
(2)上述六种物质或粒子的组成元素中有三种处于同一周期,请写出这三种元素第一电离能由大到小的顺序:N>O>C.
(3)上述六种物质或粒子中互为等电子体的是CH4、NH4+(写出化学式).
(4)F分子的中心原子杂化类型是sp3杂化,F易溶于E,其原因是NH3和H2O为极性分子符合相似相溶原理,且NH3和H2O分子之间能形成氢键.
分析 A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有正四面体结构或结构单元,D是阳离子,故D为NH4+;C、D、E、F含有相等的电子数,故电子数为10,D与F的组成元素相同,故F为NH3;由E构成的物质常温下呈液态,故E为H2O;C、E、F的晶体类型相同,属于分子晶体,故C为CH4;A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应,A为金刚石,B为二氧化硅.
解答 解:A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有正四面体结构或结构单元,D是阳离子,故D为NH4+;C、D、E、F含有相等的电子数,故电子数为10,D与F的组成元素相同,故F为NH3;由E构成的物质常温下呈液态,故E为H2O;C、E、F的晶体类型相同,属于分子晶体,故C为CH4;A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应,A为金刚石,B为二氧化硅.
(1)碳与二氧化硅反应生成硅与一氧化碳,反应方程式为SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;同主族的第四周期元素基态原子的外围电子排布式为4s24p2.
故答案为:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;4s24p2.
(2)上述六种物质或粒子的组成元素中C、N、O三种处于同一周期,同周期自左而右等于电离能增大,但N元素的2p能级处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故C、N、O三元素第一电离能由大到小的顺序:N>O>C.
故答案为:N>O>C.
(3)原子数相同,电子数目相同的为等电子体,CH4、NH4+ 是等电子体.
故答案为:CH4、NH4+.
(4)F分子是NH3,中心原子N原子成3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化;NH3和H2O为极性分子符合相似相溶原理,且NH3和H2O分子之间能形成氢键,所以氨气易溶于水.
故答案为:sp3杂化;NH3和H2O为极性分子符合相似相溶原理,且NH3和H2O分子之间能形成氢键.
点评 考查物质的推断、电离能、等电子体、杂化轨道与分子的结构与性质关系等,难度难度中等,推断物质或微粒是解题的根据,注意中学常见的检验正四面体根据的物质,D是阳离子具有正四面体结构是推断的突破口,需要学生具有扎实的基础.

| 金属 | 冶炼原理 | |
| A | Fe | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 |
| B | Hg | 2HgO $\frac{\underline{\;\;△\;\;}}{\;}$ 2Hg+O2↑ |
| C | Al | 2AlCl3(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Al+3Cl3↑ |
| D | Na | 2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Na+Cl2↑ |
| A. | A | B. | B | C. | C | D. | D |
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
(2)丙同学认为甲、乙的判断都不充分.丙认为:
①只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙(填“甲”或“乙”)判断正确.试剂X是B.
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
②将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则甲(填“甲”或“乙”)判断正确.
③查阅资料,发现NaHCO3的分解温度为150℃,丙断言乙(填“甲”或“乙”)判断是错误的,理由是常压下加热NaHCO3的水溶液,溶液的温度达不到150℃.
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
| A. | H2(g)的燃烧热为571.6 kJ•mol-1 | |
| B. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol-1 |
| A. | 氯乙烷与NaOH溶液共热,在水解后的溶液中加入硫酸,再加入AgNO3溶液检验Cl- | |
| B. | 将电石和水反应后的气体通入溴水中,如果溴水褪色,证明乙炔和溴发生了反应 | |
| C. | 实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中 | |
| D. | 向苯酚浓溶液中滴入少量浓溴水可观察到白色三溴苯酚沉淀 |