题目内容
19.有二氧化碳与一氧化碳的混合气体共11.6g,其物质的量为0.3mol.求:(1)该混合气体在标准状况下的密度为多少?
(2)混合气体缓慢通过1000mL0.12mol•L-1的氢氧化钡溶液,产生沉淀的质量为多少?
(说明:本题需要写出简明的解题过程.)
分析 (1)根据V=nVm计算混合气体总体积,再根据ρ=$\frac{m}{V}$计算混合气体密度;
(2)设CO2的物质的量为x,则CO的物质的量为(0.3mol-x),则44g•mol-1×x+28g•mol-1×(0.3mol-x)=11.6g,解得x=0.2mol,Ba(OH)2物质的量为0.12 mol,由于1<$\frac{n(C{O}_{2})}{n[Ba(OH)_{2}]}$=$\frac{5}{3}$<2,故反应生成BaCO3、Ba(HCO3)2,根据钡离子、碳原子守恒列方程计算BaCO3、Ba(HCO3)2的物质的量,再根据m=nM计算BaCO3的质量.
解答 解:(1)该混合气体在标准状况下的密度为$\frac{11.6g}{0.3mol×22.4L/mol}$=1.73g•L-1,
答:该混合气体在标准状况下的密度为1.73g•L-1.
(2)设CO2的物质的量为x,则CO的物质的量为(0.3mol-x),则:
44g•mol-1×x+28g•mol-1×(0.3mol-x)=11.6g
解得 x=0.2mol
由于1<$\frac{n(C{O}_{2})}{n[Ba(OH)_{2}]}$=$\frac{5}{3}$<2,故反应生成BaCO3、Ba(HCO3)2,
根据钡离子守恒:n(BaCO3)+n[Ba(HCO3)2]=0.12mol
根据碳原子守恒:n(BaCO3)+2n[Ba(HCO3)2]=0.2mol
解得n(BaCO3)=0.04mol,n[Ba(HCO3)2]=0.12mol
故产生沉淀质量为0.04 mol×197g•mol-1=7.88g,
答:产生沉淀质量为7.88g.
点评 本题考查混合物计算,(2)中关键是判断二氧化碳与氢氧化钡反应产物,注意利用守恒法计算,难度中等.

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案| A. | 由一种元素组成的物质可能是混合物 | |
| B. | 能电离出氢离子的化合物不一定是酸 | |
| C. | 浊液、胶体、溶液的本质区别是分散剂粒子大小 | |
| D. | 电解质与非电解质的分类标准是化合物在水溶液或熔化状态下能否导电 |
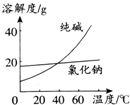 阅读并分析下列两个材料.
阅读并分析下列两个材料.材料一:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇 (C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇 (C3H8O3) | 17.9 | 290 | 1.26 | 能跟水和乙醇 以任意比互溶 |
已知常见的物质分离的方法有:
A.蒸馏法;B.萃取法;C.“溶解、蒸发浓缩、冷却结晶、过滤”的方法;D.分液法.
根据上述材料及所学知识,回答下列问题:
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,最好选用C(填序号,下同).
(2)将乙二醇和丙三醇相互分离的最佳方法是A.
(3)从溴水中提取溴单质的最佳方法是B或BD.
(4)分离汽油和水的最佳方法是D.
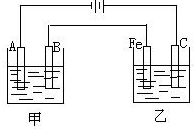 如图,甲、乙为相互串联的两个电解池,请回答下列问题:
如图,甲、乙为相互串联的两个电解池,请回答下列问题: