题目内容
11.X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示.Z为地壳中含量最多的金属元素,下列说法中正确的是( )| X | Y | |||
| Z | W | Q |
| A. | X、Y、W三种元素最低价氢化物的沸点依次升高 | |
| B. | 原子半径:Q>W>Z>Y>X | |
| C. | 最高价氧化物对应水化物的酸性:Q>W>Z | |
| D. | X及Q的气态氢化物相反应,形成的化合物为离子化合物 |
分析 由X,Y,Z,W在周期表中相对位置,并且Z元素在地壳中的含量最高,可知X是N元素,Y是O元素,Z是Al元素,W是S元素,Q为Cl元素,利用元素周期律的递变规律和在周期表中的位置解答该题相关知识.
解答 解:由X,Y,Z,W在周期表中相对位置,并且Z元素在地壳中的含量最高,可知X是N元素,Y是O元素,Z是Al元素,W是S元素,Q为Cl元素,
A.X、Y分别为N、O元素,对应的氢化物含有氢键,沸点较高,都大于S的氢化物的沸点,故A错误;
B.同周期元素从左到右原子半径逐渐减小,则原子半径Q<W<Z,Y<X,故B错误;
C.非金属性Cl>S>Al,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性越强,故C正确;
D.X及Q的气态氢化物相反应生成NH4Cl,为离子化合物,故D正确.
故选CD.
点评 本题考查位置、结构、性质的关系及应用,把握元素在周期表中的位置及元素周期律为解答的关键,注意利用实例分析,侧重分析能力和归纳能力的考查,注意短周期中一些元素的特殊性.题目难度不大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
2.下列说法中正确的是( )
| A. | NaOH溶液于水时仅破坏了离子键而未破坏共价键 | |
| B. | NH4Cl溶解于水时不仅破坏了离子键还破坏了共价键 | |
| C. | H2SO4溶解于水时,所有的共价键都被破坏 | |
| D. | HCl溶解于水时电离出H+和Cl-,所以共价键变成了离子键 |
19. 短周期元素X、Y、Z、W在周期表中的相对位置如图,X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐.下列判断错误的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐.下列判断错误的是( )
 短周期元素X、Y、Z、W在周期表中的相对位置如图,X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐.下列判断错误的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐.下列判断错误的是( )| A. | 最简单气态氢化物的稳定性:X>Y | |
| B. | 单核阴离子半径:Z>W | |
| C. | 含Z元素的盐溶液可能显酸性、碱性或中性 | |
| D. | W元素的单质具有漂白性,常用于自来水的杀菌消毒 |
6. C2H5OH、NaClO、H2O2、SO2等常用于杀菌消毒或抑制微生物生长.
C2H5OH、NaClO、H2O2、SO2等常用于杀菌消毒或抑制微生物生长.
(1)写出O2-的结构示意图 .
.
(2)医疗上常用75%的乙醇水溶液作消毒剂,其原理是75%的乙醇水溶液可以使蛋白质变性.
(3)采用无隔膜电解饱和食盐水制NaClO,C12与NaOH溶液充分接触,产物仅为NaClO和H2;NaClO水溶液中存在平衡:ClO-(aq)+H2O?HClO(aq)+OH-(aq) 写出该反应的平衡常数表达式$\frac{c(HClO)•c(O{H}^{-})}{c(Cl{O}^{-})}$.
(4)Na2O2、K2O2、BaO2都可与酸作用生成H2O2.实验室可通过上述某种过氧化物与适量稀硫酸作用并过滤,即可制得H2O2溶液,写出该过氧化物与稀硫酸反应的化学方程式BaO2+H2SO4=BaSO4+H2O2.
(5)SO2能被氧气氧化为SO3.查得部分数据如下:
已知,1mol气态SO3转化为液态SO3放出b kJ热量.常温下,SO2被氧气氧化为SO3的热化学反应方程式为2SO2(g)+O2(g)=2SO3(l)△H=-(a+2b)kJ•mol-1.
 C2H5OH、NaClO、H2O2、SO2等常用于杀菌消毒或抑制微生物生长.
C2H5OH、NaClO、H2O2、SO2等常用于杀菌消毒或抑制微生物生长.(1)写出O2-的结构示意图
 .
.(2)医疗上常用75%的乙醇水溶液作消毒剂,其原理是75%的乙醇水溶液可以使蛋白质变性.
(3)采用无隔膜电解饱和食盐水制NaClO,C12与NaOH溶液充分接触,产物仅为NaClO和H2;NaClO水溶液中存在平衡:ClO-(aq)+H2O?HClO(aq)+OH-(aq) 写出该反应的平衡常数表达式$\frac{c(HClO)•c(O{H}^{-})}{c(Cl{O}^{-})}$.
(4)Na2O2、K2O2、BaO2都可与酸作用生成H2O2.实验室可通过上述某种过氧化物与适量稀硫酸作用并过滤,即可制得H2O2溶液,写出该过氧化物与稀硫酸反应的化学方程式BaO2+H2SO4=BaSO4+H2O2.
(5)SO2能被氧气氧化为SO3.查得部分数据如下:
| 熔点(℃) | 沸点(℃) | |
| SO2 | -75.5 | -10 |
| SO3 | 16.8 | 44.8 |
3.图中甲池是以甲醇为原料,KOH为电解质的高效燃料电池,电化学过程的如图.

下列说法中不正确的是( )

下列说法中不正确的是( )
| A. | 甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O | |
| B. | 若乙池中为足量AgNO3溶液,则阳极的电极反应为:4OH--4e-═2H2O+O2↑ | |
| C. | 若乙池中为一定量CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为0.2NA | |
| D. | 常温常压下,1gCH3OH燃料生成CO2和液态H2O时放热22.68 kJ,表示该反应的热化学方程式为:CH3OH(l)+1.5O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1 |
17.如图是CO2电催化还原为CH4的工作原理示意图.下列说法不正确的是( )
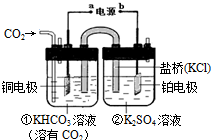

| A. | 该过程是电能转化为化学能的过程 | |
| B. | 铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O | |
| C. | 一段时间后,②池中溶液的pH一定增大 | |
| D. | 盐桥中K+移向铜电极 |
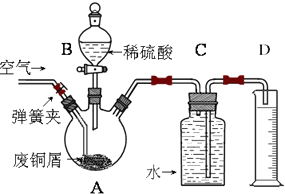 一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.
一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.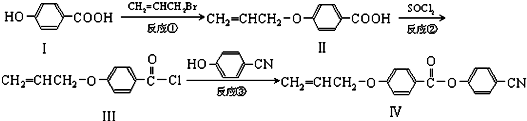
 .
. 也可与III发生类似反应③的反应,生成有机物V,V的结构简式是
也可与III发生类似反应③的反应,生成有机物V,V的结构简式是 .
.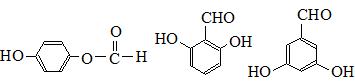 .
.