题目内容
3.图中甲池是以甲醇为原料,KOH为电解质的高效燃料电池,电化学过程的如图.
下列说法中不正确的是( )
| A. | 甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O | |
| B. | 若乙池中为足量AgNO3溶液,则阳极的电极反应为:4OH--4e-═2H2O+O2↑ | |
| C. | 若乙池中为一定量CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为0.2NA | |
| D. | 常温常压下,1gCH3OH燃料生成CO2和液态H2O时放热22.68 kJ,表示该反应的热化学方程式为:CH3OH(l)+1.5O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1 |
分析 A.甲池是甲醇氧气燃料电池反应,根据碱性条件书写方程式;
B.若乙池中为足量AgNO3溶液,则阳极阴离子放电,发生失电子的氧化反应;
C.乙池加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH,发生如下电解:
2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4、2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,Cu(OH)2从组成上可看成CuO,•H2O,根据“析出什么加入什么”的原则知,析出的物质是氧化铜和水,则阴极上析出氢气和铜,生成0.1mol铜转移电子=0.1mol×2mol=0.2mol,根据原子守恒知,生成0.1mol水需要0.1mol氢气,生成0.1mol氢气转移电子=0.1mol×2mol=0.2mol,所以电解过程中共转移电子数为0.4mol;
D.1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.32g甲醇燃烧生成二氧化碳和液态水放出热量为725.76kJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1.
解答 解:A.甲池是甲醇氧气燃料电池反应,燃料燃烧的产物二氧化碳与氢氧化钾反应生成碳酸钾,总反应为:2CH3OH+3O2+4KOH═2K2CO3+6H2O,故A正确;
B.若乙池中为足量AgNO3溶液,则阳极阴离子放电,发生失电子的氧化反应,电极反应为:4OH--4e-=2H2O+O2↑,故B正确;
C.乙池加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH,发生如下电解:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4、2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,Cu(OH)2从组成上可看成CuO,•H2O,根据“析出什么加入什么”的原则知,析出的物质是氧化铜和水,则阴极上析出氢气和铜,生成0.1mol铜转移电子=0.1mol×2mol=0.2mol,根据原子守恒知,生成0.1mol水需要0.1mol氢气,生成0.1mol氢气转移电子=0.1mol×2mol=0.2mol,所以电解过程中共转移电子数为0.4mol,即0.4NA,故C错误;
D.1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.32g甲醇燃烧生成二氧化碳和液态水放出热量为725.76kJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1,故D正确;
故选:C.
点评 本题考查了原电池和电解池原理,涉及电极反应式的书写、热化学反应方程式、物质的量的计算等知识点,这些知识点都是考试热点,根据串联电路中转移电子相等进行计算,难点是电极反应式的书写,题目难度中等.


| A. | 对羟基扁桃酸可以发生消去反应、取代反应和缩聚反应 | |
| B. | 苯酚和对羟基扁桃酸是同系物 | |
| C. | 乙醛酸与H2在热的镍催化下反应生成乙二醇 | |
| D. | 在核磁共振氢谱中对羟基扁桃酸应该有6个吸收峰 |
| A. | 酸性高锰酸钾溶液 | B. | 溴化钠溶液 | ||
| C. | 溴水 | D. | 硝酸银溶液 |
| X | Y | |||
| Z | W | Q |
| A. | X、Y、W三种元素最低价氢化物的沸点依次升高 | |
| B. | 原子半径:Q>W>Z>Y>X | |
| C. | 最高价氧化物对应水化物的酸性:Q>W>Z | |
| D. | X及Q的气态氢化物相反应,形成的化合物为离子化合物 |
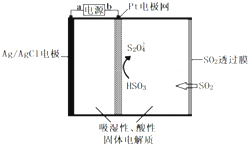
| A. | b为电源的正极 | |
| B. | 负极反应式 Ag-e-+Cl-═AgCl | |
| C. | 当电路中电子转移为5×10-5 mol时,进入传感器的SO2为 1.12 mL | |
| D. | 阴极的电极反应式是:2HSO3-+2H++2e-═S2O42-+2H2O |
| A. | 含0.1 molL-1SO2的溶液中:Na+、Ba2+、Br-、Cl- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、Mg2+、NO${\;}_{3}^{-}$、SiO${\;}_{3}^{2-}$ | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液中:K+、NH${\;}_{4}^{+}$、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | |
| D. | 不能使酚酞变红的无色溶液中:Na+、K+、ClO-、I- |
 科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振表明其分子中氢原子的化学环境没有区别,根据分析,绘制了分子的球棍模型,如图,下列说法中不正确的是( )
科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振表明其分子中氢原子的化学环境没有区别,根据分析,绘制了分子的球棍模型,如图,下列说法中不正确的是( )| A. | 该烃X与等质量的甲烷相比,X燃烧时消耗的氧气更多 | |
| B. | 分子中碳原子的化学环境有2种 | |
| C. | 分子中的氢原子分布在两个互相垂直的直线上 | |
| D. | 分子中有C-C键,也有C=C键 |