题目内容
6. C2H5OH、NaClO、H2O2、SO2等常用于杀菌消毒或抑制微生物生长.
C2H5OH、NaClO、H2O2、SO2等常用于杀菌消毒或抑制微生物生长.(1)写出O2-的结构示意图
 .
.(2)医疗上常用75%的乙醇水溶液作消毒剂,其原理是75%的乙醇水溶液可以使蛋白质变性.
(3)采用无隔膜电解饱和食盐水制NaClO,C12与NaOH溶液充分接触,产物仅为NaClO和H2;NaClO水溶液中存在平衡:ClO-(aq)+H2O?HClO(aq)+OH-(aq) 写出该反应的平衡常数表达式$\frac{c(HClO)•c(O{H}^{-})}{c(Cl{O}^{-})}$.
(4)Na2O2、K2O2、BaO2都可与酸作用生成H2O2.实验室可通过上述某种过氧化物与适量稀硫酸作用并过滤,即可制得H2O2溶液,写出该过氧化物与稀硫酸反应的化学方程式BaO2+H2SO4=BaSO4+H2O2.
(5)SO2能被氧气氧化为SO3.查得部分数据如下:
| 熔点(℃) | 沸点(℃) | |
| SO2 | -75.5 | -10 |
| SO3 | 16.8 | 44.8 |
分析 (1)O2-有8个质子,核外有10个电子;
(2)乙醇可使蛋白质变性;
(3)阳极生成氯气,氯气和氢氧化钠反应生成NaClO,阴极生成氢气;平衡常数等于生成物浓度幂之积除以反应物浓度幂之积;
(4)过氧化物与适量稀硫酸作用并过滤,即可制得H2O2溶液,说明生成硫酸盐沉淀,应为硫酸钡;
(5)由图可知2molSO2被氧气氧化为SO3放出akJ的能量,结合1mol气态SO3转化为液态SO3放出b kJ热量计算.
解答 解:(1)O2-有8个质子,核外有10个电子,则O2-的结构示意图为 ,故答案为:
,故答案为: ;
;
(2)75%的乙醇水溶液可以使蛋白质变性,则可用于杀菌消毒,故答案为:75%的乙醇水溶液可以使蛋白质变性;
(3)阳极生成氯气,氯气和氢氧化钠反应生成NaClO,阴极生成氢气,平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,K=$\frac{c(HClO)•c(O{H}^{-})}{c(Cl{O}^{-})}$,
故答案为:H2;$\frac{c(HClO)•c(O{H}^{-})}{c(Cl{O}^{-})}$;
(4)过氧化物与适量稀硫酸作用并过滤,即可制得H2O2溶液,说明生成硫酸盐沉淀,应为硫酸钡,则氧化物为BaO2,反应的方程式为BaO2+H2SO4=BaSO4+H2O2,
故答案为:BaO2+H2SO4=BaSO4+H2O2;
(5)由图可知2molSO2被氧气氧化为SO3气体放出akJ的能量,且1mol气态SO3转化为液态SO3放出b kJ热量,则热化学方程式为2SO2(g)+O2(g)=2SO3(l)△H=-(a+2b) kJ•mol-1,
故答案为:2SO2(g)+O2(g)=2SO3(l)△H=-(a+2b) kJ•mol-1.
点评 本题考查较为综合,涉及C2H5OH、NaClO、H2O2、SO2等物质的性质以及应用,多角度考查学生的分析能力,题目难度适中,有利于培养学生良好的科学素养.

 备战中考寒假系列答案
备战中考寒假系列答案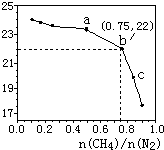 已知:在700℃的恒温、恒容密闭容器中发生反应3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4与N2在不同投料比$\frac{n(C{H}_{4})}{n({N}_{2})}$时CH4的平衡转化率如图所示,下列说法正确的是( )
已知:在700℃的恒温、恒容密闭容器中发生反应3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4与N2在不同投料比$\frac{n(C{H}_{4})}{n({N}_{2})}$时CH4的平衡转化率如图所示,下列说法正确的是( )| A. | n(CH4)/n(N2)越大,CH4的转化率越高 | |
| B. | a点对应的平衡常数比c点的大 | |
| C. | b点对应的NH3的体积分数为26% | |
| D. | 不改变投料比,增加n(N2)时,NH3体积分数增大 |
 X、Y、Z、W四种短周期元素(其中只有一种是金属元素)在周期表中的相对位置如图所示.下列说法正确的是( )
X、Y、Z、W四种短周期元素(其中只有一种是金属元素)在周期表中的相对位置如图所示.下列说法正确的是( )| A. | 简单离子的半径:X3+>Z3- | |
| B. | 元素Z的最外层电子可能为6 | |
| C. | 元素Y的最高价氧化物的水化物可能是强酸 | |
| D. | 元素W的最高价氧化物的水化物属于共价化合物 |
| A. | 酸性高锰酸钾溶液 | B. | 溴化钠溶液 | ||
| C. | 溴水 | D. | 硝酸银溶液 |
| X | Y | |||
| Z | W | Q |
| A. | X、Y、W三种元素最低价氢化物的沸点依次升高 | |
| B. | 原子半径:Q>W>Z>Y>X | |
| C. | 最高价氧化物对应水化物的酸性:Q>W>Z | |
| D. | X及Q的气态氢化物相反应,形成的化合物为离子化合物 |
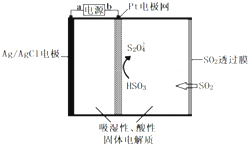
| A. | b为电源的正极 | |
| B. | 负极反应式 Ag-e-+Cl-═AgCl | |
| C. | 当电路中电子转移为5×10-5 mol时,进入传感器的SO2为 1.12 mL | |
| D. | 阴极的电极反应式是:2HSO3-+2H++2e-═S2O42-+2H2O |
 科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振表明其分子中氢原子的化学环境没有区别,根据分析,绘制了分子的球棍模型,如图,下列说法中不正确的是( )
科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振表明其分子中氢原子的化学环境没有区别,根据分析,绘制了分子的球棍模型,如图,下列说法中不正确的是( )| A. | 该烃X与等质量的甲烷相比,X燃烧时消耗的氧气更多 | |
| B. | 分子中碳原子的化学环境有2种 | |
| C. | 分子中的氢原子分布在两个互相垂直的直线上 | |
| D. | 分子中有C-C键,也有C=C键 |
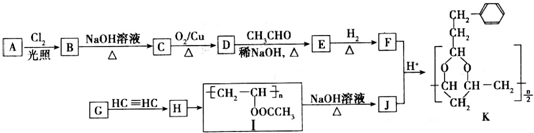
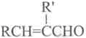 +H2O(R,R′表示烃基或氢)
+H2O(R,R′表示烃基或氢)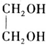 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$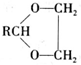 +H2O
+H2O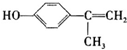 (写结构简式).
(写结构简式).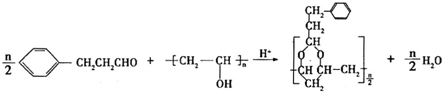 .
.