题目内容
16.下列反应生成物不受反应物的用量或浓度影响的是( )| A. | 硫酸与氯化钠反应 | B. | 硝酸银溶液中滴加稀氨水 | ||
| C. | 铁在硫蒸气中燃烧 | D. | 铁粉加入硝酸中 |
分析 A.与硫酸用量有关;
B.与氨水的用量有关;
C.反应只生成FeS;
D.与铁或硝酸的量及硝酸浓度有关.
解答 解:A.浓硫酸与氯化钠反应制取HCl,可能生成硫酸钠或硫酸氢钠,故A不选;
B.硝酸银溶液中滴加稀氨水,氨水少量生成沉淀,氨水过量生成银氨溶液,故B不选;
C.铁在硫蒸气中燃烧,生成FeS,不受反应物的用量或浓度影响,故C选;
D.铁粉加入硝酸中,可能生成硝酸铁或硝酸亚铁、NO或二氧化氮,故D不选;
故选C.
点评 本题考查物质的性质,为高频考点,综合考查元素化合物知识,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
1.用下列装置进行相应实验,能达到实验目的是( )
| A. | 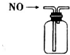 装置可收集NO气体 | |
| B. | 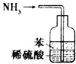 装置可吸收多余氨气且能防止倒吸 | |
| C. | 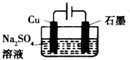 装置可实现反应:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | |
| D. | 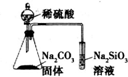 装置可证明非金属性:S>C>Si |
2.以下收集气体装置中正确的是( )
| A. |  CO的收集 CO的收集 | B. |  NO的收集(液体为H2O) NO的收集(液体为H2O) | ||
| C. |  O2的收集 O2的收集 | D. |  NH3的收集(液体为H2O) NH3的收集(液体为H2O) |
4.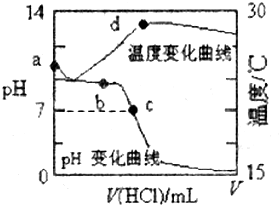 室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )
室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )
 室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )
室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )| A. | a 点由水电离出的c(H+)=1.0×10-14 mol/L | |
| B. | b:c (NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | c点:c(Cl-)=c(NH4+) | |
| D. | d点后,溶液温度略有下降的主要原因是NH3•H2O电离吸热 |
11.下列物质所含粒子数为0.1NA(NA为阿伏加德罗常数的值)的是( )
| A. | 0.1molNa2O2所含的阴离子 | |
| B. | 1L0.1mol•L-1氨水中的NH4+ | |
| C. | 12.5mL16mol•L-1的浓硫酸能溶解的Cu | |
| D. | 4.6gNO2气体所含的分子 |
1.某同学设计原电池装置如图所示.下列说法正确的是( )


| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e-=Fe | |
| D. | 若转移2mole-,交换膜右侧溶液中约减少3 mol离子 |
8.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同族,丁原子最外层电子数与电子层数相等,则( )
| A. | 原子半径:乙>丙>丁 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 乙、丙、丁的最髙价氧化物对应的水化物能相互反应 | |
| D. | 甲、乙、丙的氧化物均为共价化合物 |
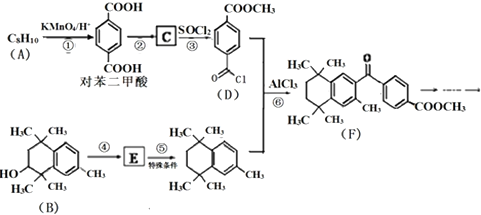
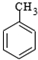 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$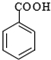
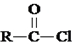
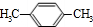 .
.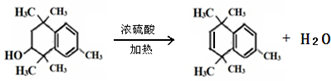 .
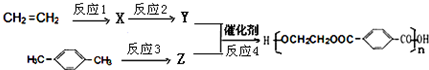
.
 .
.