题目内容
11.下列物质所含粒子数为0.1NA(NA为阿伏加德罗常数的值)的是( )| A. | 0.1molNa2O2所含的阴离子 | |
| B. | 1L0.1mol•L-1氨水中的NH4+ | |
| C. | 12.5mL16mol•L-1的浓硫酸能溶解的Cu | |
| D. | 4.6gNO2气体所含的分子 |
分析 A、Na2O2由2个钠离子和1mol过氧根构成;
B、铵根离子是弱碱阳离子,在溶液中会水解;
C、铜只能与浓硫酸反应,与稀硫酸不反应;
D、二氧化氮气体中存在平衡:2NO2?N2O4,导致气体分子数减少.
解答 解:A、Na2O2由2个钠离子和1mol过氧根构成,故0.1mol过氧化钠中含0.1mol阴离子,即0.1NA个,故A正确;
B、铵根离子是弱碱阳离子,在溶液中会水解,故在溶液中含有的铵根离子的物质的量小于0.1mol,小于0.1NA个,故B错误;
C、铜只能与浓硫酸反应,与稀硫酸不反应,则12.5mL16mol•L-1的浓硫酸即0.2mol浓硫酸不能完全反应,则能溶解的铜的物质的量小于0.1mol,故C错误;
D、4.6g二氧化氮的物质的量即0.1mol,而二氧化氮气体中存在平衡:2NO2?N2O4,导致气体分子数减少,故气体中的分子个数小于0.1NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列各项实验的基本操作中,正确的是( )
| A. | 为了加快过滤速度,可用玻璃棒搅拌过滤器中的液体 | |
| B. | 为了防止容量瓶漏液,可在玻璃塞上涂上凡士林 | |
| C. | 为了使制取氢气的速率加快,可向稀硫酸中加入少量硫酸铜溶液 | |
| D. | 为了使配制的FeCl3溶液不产生混浊,可加入盐酸和铁片 |
17.某无色溶液中只可能含有Na+、Ba2+、Cl-、Br-、SO32-、SO42-离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:下列结论正确的是( )
| 步骤 | 操作 | 现象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4震荡,静置 | CCl4层呈橙色 |
| ③ | 向②所得溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A. | 肯定含有的离子是Na+、Br-、SO32- | B. | 肯定没有的离子是Ba2+、SO32- | ||
| C. | 可能含有的离子是Cl-、Br-、SO42- | D. | 不能确定的离子是Cl-、SO42- |
6.下列结论错误的是( )
| A. | 氧化性:F2>Cl2>S | B. | 稳定性:HF>HCl>H2S>PH3 | ||
| C. | 离子半径:K+>Al3+>S2->Cl- | D. | 酸性:HClO4>H2SO4>H3PO4>HClO |
16.下列反应生成物不受反应物的用量或浓度影响的是( )
| A. | 硫酸与氯化钠反应 | B. | 硝酸银溶液中滴加稀氨水 | ||
| C. | 铁在硫蒸气中燃烧 | D. | 铁粉加入硝酸中 |
3. 向1000mL3mol•L-1NaOH溶液中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线图所示,下列说法中正确的( )
向1000mL3mol•L-1NaOH溶液中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线图所示,下列说法中正确的( )
 向1000mL3mol•L-1NaOH溶液中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线图所示,下列说法中正确的( )
向1000mL3mol•L-1NaOH溶液中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线图所示,下列说法中正确的( )| A. | 水的电离程度一直增大 | |
| B. | 溶液的pH逐渐下降 | |
| C. | M、N两点对应的溶液中离子种类不同 | |
| D. | CD段反应的离子方程式为OH-+CO2=HCO3- |
1.设NA为阿伏伽德罗常数的数值.下列叙述正确的是( )
| A. | 标况下11.2L乙烷分子中所含分子数为0.5NA | |
| B. | 1.8g的NH4+中含有的电子数为0.1NA | |
| C. | 20克氖气所含原子数为0.5NA | |
| D. | 常温常压下,48g O3和O2的混合气体中,含有氧原子数为3NA |
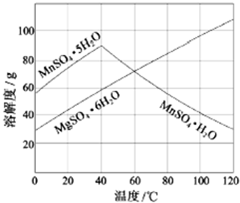 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4