题目内容
1.某同学设计原电池装置如图所示.下列说法正确的是( )
| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e-=Fe | |
| D. | 若转移2mole-,交换膜右侧溶液中约减少3 mol离子 |
分析 A.电子由负极流向正极;
B.右侧中铁离子得电子生成亚铁离子;
C.正极上铁离子得电子生成亚铁离子;
D.转移2mole-,则右侧中有2molCl-进入左侧.
解答 解:A.Fe为负极,Pt为正极,电子由负极流向正极,即电子由铁极经导线向铂极迁移,电子不能通过溶液,故A错误;
B.右侧中铁离子得电子生成亚铁离子,电极反应为Fe3++e-=Fe2+,溶液颜色变浅,故B正确;
C.正极上铁离子得电子生成亚铁离子,则正极的电极反应式为Fe3++e-=Fe2+,故C错误;
D.转移2mol电子时,正极附近电解质溶液中大约有2molCl-透过阴离子交换膜向铁极附近迁移(交换膜左侧溶液),Fe3+变Fe2+,阳离子数目没有改变,交换膜右侧溶液中离子约减少2molCl-,故D错误.
故选B.
点评 本题考查原电池知识,侧重于原电池的原理的应用的考查,注意把握电解方程式的书写以及原电池的工作原理,难度不大.

练习册系列答案
相关题目
6.已知某种气态化石燃料只含有碳和氢两种元素.为了测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体(包括水)全部通入如图所示的装置,得到如表所示的实验数据(左侧U形管中干燥剂至吸收水蒸气且假设产生的气体完全被吸收,忽略澄清石灰水中的水分损失)
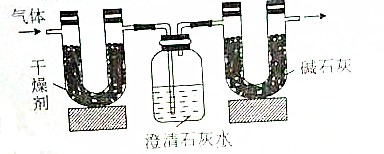
根据实验数据回答下列问题:
(1)实验完毕后,生成物中水的质量为1.35g,假设广口瓶里生成一种正盐,其质量为5g
(2)生成的水中氢元素的质量为0.15g.
(3)生成的CO2中碳元素的质量为0.6g.
(4)气态化石燃料的分子式为C2H6.

| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 51.10g | 52.45g |
| (澄清石灰水+广口瓶)的质量 | 408.00g | 410.20 |
(1)实验完毕后,生成物中水的质量为1.35g,假设广口瓶里生成一种正盐,其质量为5g
(2)生成的水中氢元素的质量为0.15g.
(3)生成的CO2中碳元素的质量为0.6g.
(4)气态化石燃料的分子式为C2H6.
7.下列说法正确的是( )
| A. | 气体的摩尔体积是22.4L | |
| B. | 1L 1mol/L MgCl2溶液中Cl-的物质的量浓度为1mol/L | |
| C. | 1mol NaOH的质量为40g | |
| D. | 1mol氧和1mol水所含的分子数相等 |
9.下列说法正确的是( )
| A. | 乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 | |
| B. | 二氧化氯和三氯化铁都常用于自来水的处理,二者的作用原理相同 | |
| C. | Ksp不仅与难溶电解质的性质和温度有关,而且还与溶液中的离子浓度有关 | |
| D. | 7.8g过氧化钠含有的共用电子对数为0.1NA |
16.下列反应生成物不受反应物的用量或浓度影响的是( )
| A. | 硫酸与氯化钠反应 | B. | 硝酸银溶液中滴加稀氨水 | ||
| C. | 铁在硫蒸气中燃烧 | D. | 铁粉加入硝酸中 |
6.下列实验操作可以达到实验目的是( )
| A. | 用铝片与氧化铁混合加热进行铝热反应 | |
| B. | 将蔗糖溶于水,加热几分钟后再加人少量新制的Cu(OH)2就可实现将蔗糖水解,并用新制的Cu(OH)2检验蔗糖的水解产物 | |
| C. | 用溴的四氯化碳溶液就能鉴别乙烷与乙烯 | |
| D. | 向裂化汽油中加人酸性高锰酸钾溶液,振荡,紫色褪去说明汽油中含有甲苯等苯的同系物 |
11.下列离子方程式的书写正确的是( )
| A. | 在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO42-=BaSO4↓ | |
| B. | 钠与水的反应Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氯气通入氢氧化钠溶液中 2Cl2+2OH-=3Cl-+ClO-+H2O | |
| D. | 大理石溶于醋酸的反应CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
 .
.
 .
. .
. .
. 或
或  的邻、间、对的任意一种.
的邻、间、对的任意一种.