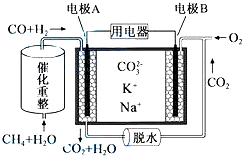
题目内容
15.下列关于粒子结构的描述不正确的是( )| A. | CH3CH(NO2)COOH分子中含有“手性碳原子” | |
| B. | HS-和HC1均是含一个极性键的18电子粒子 | |
| C. | 当用带有静电的玻璃棒接近CH2Cl2和CC14液体细流时,细流都不发生偏转 | |
| D. | 1mol己烷含有的共价键数目为19NA(NA代表阿伏加德罗常数) |
分析 A、根据手性碳原子指连有四个不同基团的碳原子,手性碳原子判断注意:(1)手性碳原子一定是饱和碳原子;(2)手性碳原子所连接的四个基团要是不同的;
B、HS-和HCl均是含18个电子,含有一个极性键;
C、用带静电的有机玻璃棒靠近下列液体的细流,若细流偏转,则细流是极性分子,不偏转则是非极性分子,据此即可解答;
D、己烷分子式为C6H14,据此判断共价键即可.
解答 解:A、CH3CH(NO2)COOH中从左数第二个碳分别连接甲基、H原子、硝基和羧基,为手性碳原子,故A正确;
B、HS-和HCl都只含一个极性键,都具有18个电子,故B正确;
C、CH2Cl2分子结构不对称,属于极性分子,用带静电的有机玻璃棒靠近,发生偏转,故C错误;
D、己烷分子式为C6H14,含有共价键数为6-1+14=19,故1mol己烷含有的共价键数目为19NA,故D正确;
故选C.
点评 本题主要考查的是手性碳原子、极性分子与非极性分子、共价键的判断等,有一定难度.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
5.铁单质及其化合物在生活、生产中应用广泛.请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为O2+2H2O+4e-=4OH-.
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是Cu+2Fe3+=2Fe2++Cu2+.
(3)硫酸铁可作絮凝剂,常用于净水,其原理是Fe3++3H2O?Fe(OH)3+3H+(用离子方程式表示).在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是酸性环境中,氢离子抑制了铁离子的水解,无法生成氢氧化铁胶体.
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO═3Fe+4CO2,若有1.5mol Fe3O4参加反应,转移电子的物质的量是12mol.
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为O2+2H2O+4e-=4OH-.
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是Cu+2Fe3+=2Fe2++Cu2+.
(3)硫酸铁可作絮凝剂,常用于净水,其原理是Fe3++3H2O?Fe(OH)3+3H+(用离子方程式表示).在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是酸性环境中,氢离子抑制了铁离子的水解,无法生成氢氧化铁胶体.
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO═3Fe+4CO2,若有1.5mol Fe3O4参加反应,转移电子的物质的量是12mol.
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的 金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应 生成氢气 | 高温下氢气能还原氧化 铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁的表面能形 成致密的氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 |
6.下列各组分子中,中心原子均采取sp3不等性杂化的是( )
| A. | PCl3、NH3 | B. | BF3、H2O | C. | CCl4、H2S | D. | BeCl2、BF3 |
3.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 常温下,在18g18O2中含有NA个氧原子 | |
| C. | 1 mol乙烷中含有C一H的键数为7×6.02×l023 mol-1 | |
| D. | 1mol-OH所含的电子数目为7NA |
10.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液:Fe2+、Mg2+、NO${\;}_{3}^{-}$、Cl- | |
| C. | 含有大量Al3+的溶液:Na+、Cl-、AlO${\;}_{2}^{-}$、OH- | |
| D. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO${\;}_{4}^{2-}$、S2-、SO${\;}_{3}^{2-}$ |
20.取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该实验下列说法不正确的是( )
| A. | 温度越高,镁与水反应的速率越快 | |
| B. | 镁与水反应的化学方程式为:Mg+2H2O═Mg(OH)2+H2↑ | |
| C. | 氢氧化镁显碱性,且在水中有一定的溶解性 | |
| D. | 氢氧化镁是离子化合物,它的电子式可表示为: |
4.下列有关物质结构的表述正确的是( )
| A. | 乙酸的比例模型: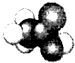 | B. | CO2的电子式: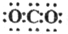 | ||
| C. | 乙醛结构简式:CH3COH | D. | 氯原子的结构示意图: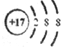 |