题目内容
4.如图是元素周期表的一部分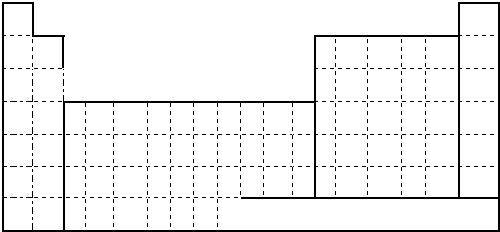
(1)请在表中画出金属与非金属的交界线
(2)请在表中标出第VⅢ的位置
(3)在表中标出${\;}_{22}^{48}$Ti的位置
(4)请在表中标出铝的位置
(5)请在表中标出非金属最强的元素.
分析 (1)最外层电子数≤周期数为金属元素,最外层电子数>周期数为非金属性元素;
(2)第VⅢ位于周期表第8、9、10纵行;
(3)Ti位于第四周期第IIIB族;
(4)主族元素原子核外电子层数等于其周期数、最外层电子数等于其族序数;
(5)非金属性最强的元素位于周期表右上角(稀有气体除外),金属性最强的元素位于周期表左下角.
解答 解:(1)最外层电子数≤周期数为金属元素,最外层电子数>周期数为非金属性元素;
(2)第VⅢ位于周期表第8、9、10纵行;
(3)Ti位于第四周期第ⅢB族,即第四周期第3纵行;
(4)主族元素原子核外电子层数等于其周期数、最外层电子数等于其族序数,Al原子核外有3个电子层、最外层有3个电子,所以位于第三周期第IIIA族;
(5)非金属性最强的元素位于周期表右上角(稀有气体除外),金属性最强的元素位于周期表左下角,所以非金属性最强的元素是F元素,
如图为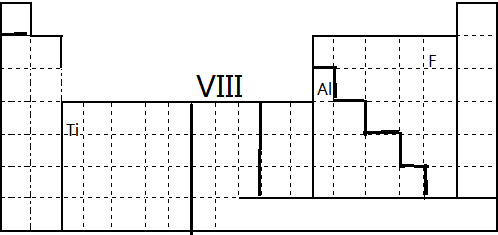 ,
,
故答案为: .
.
点评 本题考查元素周期表结构及其应用,熟悉元素周期表结构及原子结构是解本题关键,知道元素周期律并灵活运用,难点是副族排列顺序判断,题目难度不大.

练习册系列答案
相关题目
14.意大利一所大学的科学家制造出了由4个氧原子构成的一种新型分子.下列说法正确的是( )
| A. | 该分子是氧元素的一种同位素 | B. | 该分子的摩尔质量为64 g | ||
| C. | 该物质与氧气互为同素异形体 | D. | 该物质是一种氧化物 |
15.把含硫40%的硫铁矿先制成硫酸,再吸收氨气制成硫酸铵.1t这种硫铁矿在理论上能制得硫酸铵( )
| A. | 2.26 t | B. | 1.98 t | C. | 1.65 t | D. | 1.06 t |
19.某主族元素的原子,M层上有一个半充满的亚层(即该亚层的每个轨道只有1个电子),这种原子的质子数( )
| A. | 只能是7 | B. | 只能是15 | C. | 是11或15 | D. | 是11或13 |
2.下列说法正确的是( )
| A. | 原电池是把电能转化为化学能的装置 | |
| B. | 原电池两极均发生氧化还原反应 | |
| C. | 原电池中的阳离子向正极移动 | |
| D. | 原电池中电子流出的一极是正极,发生氧化反应 |
7.有a、b、c、d四种金属.将a与b用导线接起来,浸入电解质溶液中,b不易腐蚀.将a、d分别投入等浓度的盐酸中,d比a反应强烈.将铜浸入b的盐溶液里,无明显变化.如果把铜浸入c的盐溶液里,有金属c析出.据此判断它们的活动性顺序由强到弱的为( )
| A. | a>c>d>b | B. | d>a>b>c | C. | d>b>a>c | D. | b>a>d>c |
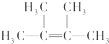 ;名称是2,3-二甲基-2-丁烯.
;名称是2,3-二甲基-2-丁烯.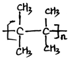 .
. 、(CH3CH2)2C=CH2.
、(CH3CH2)2C=CH2.

