题目内容
15.把含硫40%的硫铁矿先制成硫酸,再吸收氨气制成硫酸铵.1t这种硫铁矿在理论上能制得硫酸铵( )| A. | 2.26 t | B. | 1.98 t | C. | 1.65 t | D. | 1.06 t |
分析 依据硫原子个数守恒,计算1t硫铁矿中含硫的物质的量,计算硫酸的物质的量,再依据硫酸铵中硫元素的质量分数计算生成硫酸铵的质量.
解答 解:原硫铁矿中硫元素质量为1t×4%=0.4t,制成硫酸后硫元素质量仍为0.4t,硫酸氨中硫元素的质量分数为$\frac{32}{132}$,实际有硫元素0.4t,因此可制得硫酸铵质量=0.4t÷$\frac{32}{132}$=1.65t,
故选:C.
点评 本题考查了有关方程式的计算,明确制备过程中硫原子个数守恒是解题关键,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
5.t℃时Na2SO4的溶解度是S g,其饱和溶液密度d g•cm-3,物质的量浓度为c mol•L-1.向足量饱和溶液中,加入X g无水Na2SO4或蒸发Yg水后恢复t℃,均能获得W g芒硝晶体,下列关系式正确的是( )
| A. | c=$\frac{dS}{142(S+100)}$ mol•L-1 | B. | S=$\frac{142W}{180W+322Y}$g | ||
| C. | X=YS | D. | W=$\frac{3220X}{1420-18S}$g |
6.下列说法正确的是( )
| A. | HF、HCl、HBr、HI 的热稳定性依次减弱 | |
| B. | HF、HCl、HBr、HI 的熔沸点逐渐升高 | |
| C. | 第ⅠA族元素和第ⅦA元素形成的化合物都属于离子化合物 | |
| D. | 因为H2O分子间存在氢键,所以热稳定性:H2O>H2S |
3.下列说法正确的是( )
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 吸热反应一定需要加热才能发生 | |
| C. | 凡是放热反应的发生均无需加热 | |
| D. | 伴有能量变化的物质变化都是化学变化 |
7.在绿色化学工艺中,理想状态是反应物中的原子全部转化为欲制得的产物.如用CH3C≡CH合成CH2=C(CH3)COOCH3,欲使原子利用率达到最高,还需要的反应物是( )
| A. | H2和CO2 | B. | CO2和H2O | C. | CO和CH3OH | D. | CH3OH和H2 |
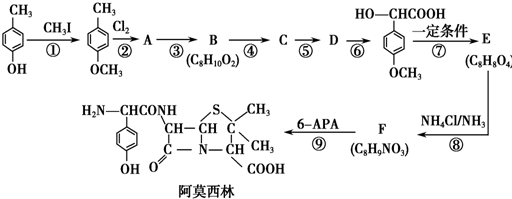
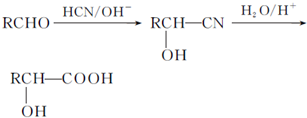

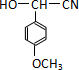 .
. .
. .
.