题目内容
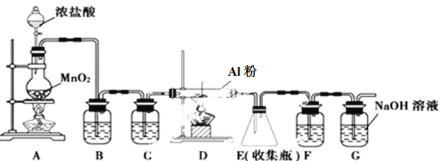
【题目】某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。

请回答下列问题:
(1)甲池为_______(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为_______。
(2)乙池中A(石墨)电极的名称为_____(填“正极”“负极”“阴极”或“阳极”),总反应式为______。
(3)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为___mL(标准状况下),丙池中___极(填C或D)析出___g铜。
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将______(填“增大”“减小”或“不变”);丙中溶液的pH将______(填“增大”“减小”或“不变”)。
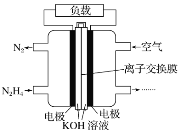
(5)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为_____;正极反应式为_______。
【答案】原电池 CH3OH-6e-+8OH-=CO32-+6H2O 阳极 4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3 280 D 1.60 减小 增大 N2H4-4e-+4OH-=N2↑+4H2O O2+4e-+2H2O=4OH-
4Ag+O2↑+4HNO3 280 D 1.60 减小 增大 N2H4-4e-+4OH-=N2↑+4H2O O2+4e-+2H2O=4OH-
【解析】
由图示可知甲池为甲醇燃料电池,燃料电池中通入燃料的一极为负极,通入氧气的一极为正极,则通入甲醇的一极为负极,燃料在负极失电子发生氧化反应,在碱溶液中生成碳酸盐,电极反应为:CH3OH+8OH--6e-=CO32-+6H2O,通入氧气的一极为正极,电极反应为O2+4e-+2H2O=4OH-;乙、丙二池为电解池,电解池中与电源正极相连的一极为阳极,与电源负极相连的一极为阴极,则A、C为两个电解池的阳极,B、D为两个电解池的阴极,乙池中电解质溶液为AgNO3,根据放电顺序,阳极A的电极反应为4OH--4e-=2H2O+O2↑,阴极B的电极反应为Ag++e-=Ag;丙池中电解质溶液为CuCl2,根据放电顺序,阳极C的电极反应为2Cl--2e-=Cl2↑,阴极D的电极反应为Cu2++2e-=Cu,据此分析解答(1)~ (4);
(5)燃料电池中,通入燃料的电极通常为负极,通入氧气的一极为正极,结合图示分析书写电极反应。
(1)根据分析,甲池为原电池,通入CH3OH电极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O;
(2)根据分析,乙池为电解池,A(石墨)电极的名称为阳极,阳极A的电极反应为4OH--4e-=2H2O+O2↑,阴极B的电极反应为Ag++e-=Ag,总反应式为4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3;
4Ag+O2↑+4HNO3;
(3)根据分析,乙池中阴极B的电极反应为Ag++e-=Ag,B极质量增加5.40 g时,即生成Ag单质的质量为5.40g,其物质的量=![]() =0.05mol,甲池中正极电极反应为O2+4e-+2H2O=4OH-,根据电子守恒计算4Ag~O2~4e-,甲池中理论上消耗O2的体积=
=0.05mol,甲池中正极电极反应为O2+4e-+2H2O=4OH-,根据电子守恒计算4Ag~O2~4e-,甲池中理论上消耗O2的体积=![]() mol×22.4L/mol =0.28L=280mL;丙为电解池,C为阳极,D为阴极,阴极D的电极反应为Cu2++2e-=Cu,结合电子守恒计算2Ag~Cu~2e-,析出铜质量=
mol×22.4L/mol =0.28L=280mL;丙为电解池,C为阳极,D为阴极,阴极D的电极反应为Cu2++2e-=Cu,结合电子守恒计算2Ag~Cu~2e-,析出铜质量=![]() ×64g/mol =1.60g;
×64g/mol =1.60g;
(4)甲中发生的反应为甲醇与氧气、氢氧化钾的反应,反应消耗氢氧根离子,则pH减小,丙中电极不变,将其溶液换成NaCl溶液,则丙中电解NaCl溶液生成氢氧化钠,所以溶液pH增大;
(5)燃料电池中,通入燃料的电极通常为负极,通入氧气的一极为正极,则通入液体燃料肼(N2H4)的一极为负极,负极发生氧化反应,由图可知负极上有N2生成,电极反应式为:N2H4-4e-+4OH-=N2↑+4H2O;通入氧气的一极为正极,正极发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-。

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案