题目内容
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是
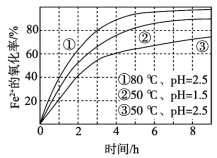
A. Fe2+的氧化率随时间延长而逐渐增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,温度越高,Fe2+氧化速率越快
D. 氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
【答案】B
【解析】
在酸性条件下,Fe2+和氧气、氢离子反应生成Fe3+和H2O,反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,由图象可知,当pH相同温度不同时,温度越高Fe2+的氧化率越大;当温度相同pH不同时,pH越大,Fe2+的氧化率越小。
A项、由图象可知,Fe2+的氧化率随时间延长而逐渐增大,故A正确;
B项、由②和③可知,当温度相同pH不同时,pH越大,Fe2+的氧化速率越小,故B错误;
C项、由①和③可知,当pH相同温度不同时,温度越高Fe2+的氧化速率越大,故C正确;
D项、在酸性条件下,Fe2+和氧气、氢离子反应生成Fe3+和H2O,反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,故D正确;
故选B。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A、E在元素周期表中的相对位置如图,A与氧元素能形成两种无色气体,C是地壳中含量最多的元素,D是地壳中含量最多的金属元素。
A | ||
E |
(1)C在元素周期表中的位置为____。
(2)AE2的电子式为___。
(3)C、E、F的单质沸点最低的是__(填化学式)。
(4)C、D、E、F的离子半径由大到小的顺序是___(填离子符号)。
(5)实验室制取F2气体的离子方程式为___。
(6)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____。
【题目】某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
实验Ⅰ |
|
实验Ⅱ | 取ⅰ中的黄色溶液少许,加入KI溶液,再加入淀粉溶液。 |
(1)ⅰ中反应的离子方程式是__________________________________________。
(2)实验Ⅰ中ⅰ和ⅱ可以得出的结论是__________________________________。
(3)①甲同学认为:实验Ⅱ观察到__________________现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
实验Ⅲ | 另取ⅰ中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液。 |
补做实验Ⅲ的目的是___________________________________________________。
(4)综合实验Ⅰ和Ⅲ,得出Cl2、Br2、I2氧化性由强到弱的顺序为_____________。
(5)实验室的氯水都是实验前新制备,其制备的方法是将氯气通往蒸馏水中使其充分溶解而得到。实验室可用如图装置来制备氯水,下列对于该实验说法正确的是___________。

A.甲装置中所用药品为浓盐酸和二氧化锰
B.若在装置乙、丙之间增加一个如图(a)所示装置,制备的氯水更纯净
C.为提高氯水的制备效率,可在丙装置中的长玻璃管下端接一个如图(b)所示的多孔球
D.为了充分吸收尾气并防止倒吸,丁装置可选用如图(c)所示装置