题目内容
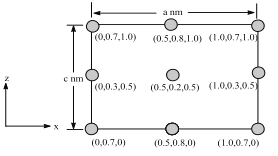
【题目】常温下,现有0.1 mol·L-1 NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

A.当pH=9时,溶液中存在下列关系:c(NH4+)>c(NH3·H2O)>c(HCO3-)>c(CO32-)
B.将0.2 mol CO2通入1 L 0.3 mol·L-1 NH3·H2O溶液中充分反应,则有:c(HCO3-)+3c(H2CO3)-c(CO32-)>0
C.向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小
D.分析可知,常温下水解平衡常数Kh(HCO3-)的数量级为10-7
【答案】B
【解析】
A.结合图象可知,溶液的pH=9时,溶液中离子浓度大小为:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-),故A错误;
B.将0.2 mol CO2通入1 L 0.3 mol·L-1 NH3·H2O溶液中充分反应,溶液相当于(NH4)2CO3 、NH4HCO3等物质的量浓度的混合液,溶液呈碱性,c(OH-)-c(H+)>0,溶液中存在电荷守恒:2c(CO32-)+c(HCO3-)+c(OH-)=c(NH4+)+c(H+),物料守恒:3c(HCO3-)+3c(H2CO3)+3c(CO32-)=2c(NH4+)+2c(NH3·H2O),得c(HCO3-)+3c(H2CO3)-c(CO32-)=2c(NH3·H2O)+2c(OH-)-2c(H+)则有:c(HCO3-)+3c(H2CO3)-c(CO32-)>0,故B正确;
C.根据图象可知,当溶液pH增大时,NH3·H2O浓度逐渐增大,则NH4+的浓度逐渐减小,而HCO3-浓度先增大后减小,故C错误;
D.HCO3-的水解平衡常数Kh(HCO3-)=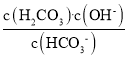 ,当pH=6.5时,c(HCO3-)=c(H2CO3),c(OH-)=
,当pH=6.5时,c(HCO3-)=c(H2CO3),c(OH-)=![]() =
=![]() =10-7.5=
=10-7.5=![]() ×10-8,Kh(HCO3-)=
×10-8,Kh(HCO3-)=![]() ×10-8,其数量级为10-8,故D错误。
×10-8,其数量级为10-8,故D错误。
故选B。

 名校课堂系列答案
名校课堂系列答案【题目】工业上可采用湿法技术从废印刷电路板中回收纯铜,其流程简图如下:
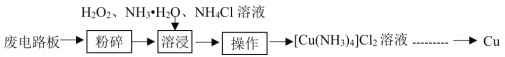
回答下列问题:
(1)开始时,将废电路板“粉碎”的目的是__________。“操作”的名称是_________________。
(2)某化学兴趣小组同学为探究“溶浸”过程中反应的实质,采用如图所示的装置,设计了如下对照实验。
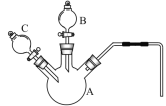
序号 | 实验名称 | 实验步骤 | 实验现象 | |
Ⅰ | 将铜片置于H2O2溶液中 | 先向A中加入0.5g光亮的铜片,再通过B加入30%的H2O2溶液 | —————— | 开始无明显现象,10小时后,溶液变为浅蓝色,铜表面附着一层蓝色固体 |
Ⅱ | 将铜片置于硫酸酸化的H2O2溶液中 | 再通过C加入8mL 5mol/L 的稀硫酸 | 开始铜片表面产生少量气泡,随着反应的进行,气泡越来越多,溶液颜色为蓝色,铜片表面保持光亮 | |
Ⅲ | 将铜片置于有氨水的H2O2溶液中 | 再快速通过C加入8mL 5mol/L的氨水 | 立即产生大量的气泡,溶液颜色变为深蓝色,铜片表面有一层蓝色固体附着,产生的气体能使带火星的木条复燃 | |
Ⅳ | 将铜片置于加有氨水和NH4Cl的H2O2溶液中 | 先向A中加入0.5g光亮的铜片和0.2g NH4Cl固体,再通过B加入30%的H2O2溶液 | 再快速通过C加入8mL 5mol/L的氨水 | 立即产生大量的气泡,______,铜片表面依然保持光亮 |
①仪器A的名称为______________________。
②实验Ⅰ中反应的化学方程式为___________________________。
③实验Ⅱ中产生的气体是________(写化学式),实验Ⅱ比实验Ⅰ/span>现象明显的原因是__________。
④实验Ⅲ中“溶液颜色变为深蓝色”所发生反应的离子方程式为________________。
⑤实验Ⅳ中空格处实验现象为__________,加入NH4Cl的作用是______________。