题目内容
1.在某无色透明的酸性溶液中,能大量共存的离子组是( )| A. | NH4+、SO42-、Al3+、Cl- | B. | Na+、OH-、K+、Cl- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | K+、NO3-、I-、Na+ |
分析 酸性溶液含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,不发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.酸性溶液中该组离子之间不反应,可大量共存,且离子均为无色,故A选;
B.酸性溶液中不能大量存在OH-,故B不选;
C.MnO4-为紫色,与无色不符,故C不选;
D.H+、NO3-、I-发生氧化还原反应,不能共存,故D不选;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
11.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
| 选项 | 操作及现象 | 溶 液 |
| A | 通入CO2,溶液变浑浊.再升温至65℃以上,溶液变澄清 | C6H5ONa溶液 |
| B | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失.再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失.再加热溶液,又变浑浊 | CaCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |
12.从下列实验事实所得出的相应结论正确的是( )
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷可自燃而氮气需在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色晶体加入氢氧化钠浓溶液中并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该晶体中一定有NH4+ |
| A. | ②③⑤ | B. | ①②③ | C. | ③④⑤ | D. | ①③⑤ |
9.如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是
 ( )
( )
 ( )
( )| A. | W的氢化物比R的氢化物稳定 | |
| B. | T的最高价氧化物水化物可能为强碱 | |
| C. | Q的原子半径比T的小 | |
| D. | W和Q的原子序数相差10 |
16.下列实验操作能达到实验目的是( )
| A. | 用湿润的KI-淀粉试纸鉴别Br2(g)和NO2(g) | |
| B. | 用新制Cu(OH)2悬浊液鉴别乙醛和丙醛 | |
| C. | 将CH4与CH2=CH2混合气体依次通过酸性KMnO4溶液、浓硫酸可得到纯净的CH4 | |
| D. | 用托盘天平、量筒、烧杯、玻璃捧配制10%的NaCl溶液 |
6.二甲酸钾是一种白色晶体,商品名为弗米(Formil),是一种能替代抗生素的促生长剂,化学式为KH(HCOO)2,具有吸湿性,易溶于水.
二甲酸钾的生产工艺流程如下:
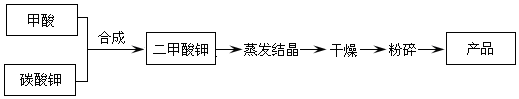
(1)以甲酸和碳酸钾为原料生产二甲酸钾,实验测得反应条件对产品回收率的影响如下:
表1 反应温度对产品回收率的影响
表2 反应物料比对产品回收率的影响
备注:表2中反应物料比为甲酸和无水碳酸钾的物质的量之比.
①写出甲酸和碳酸钾生产二甲酸钾的化学方程式:4HCOOH+K2CO3=2KH(HCOO)2+CO2↑+H2O.
②实际生产二甲酸钾时应选择的最佳反应条件是反应温度应控制在50℃∽60℃,反应物料比应选择4:1.由表1可知反应温度过高,反应回收率反而会降低,其原因可能是温度过高,甲酸易挥发.
(2)测定某弗米产品纯度的实验方法如下:
称取该弗米产品2.5g,将其全部溶解在水中,配制成250mL未知浓度的溶液,取出25.00mL于锥形瓶中,再滴加2~3滴指示剂,用0.10mol•L-1的NaOH溶液滴定至终点,消耗NaOH溶液的体积为18.50mL.
①加入的指示剂是酚酞(选填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至终点的现象是溶液由无色恰好变成浅红色且在半分钟内不褪色.
②上述弗米产品中二甲酸钾的质量分数为96.2%.
二甲酸钾的生产工艺流程如下:

(1)以甲酸和碳酸钾为原料生产二甲酸钾,实验测得反应条件对产品回收率的影响如下:
表1 反应温度对产品回收率的影响
| 反应温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 产品回收率(%) | 75.6 | 78.4 | 80.6 | 82.6 | 83.1 | 82.1 | 73.7 |
| 反应物料比 | 2:1 | 3:1 | 4:1 | 5:1 | 6:1 | 7:1 |
| 产品回收率(%) | 0 | 38.4 | 82. 6 | 83.6 | 84.5 | 84.8 |
①写出甲酸和碳酸钾生产二甲酸钾的化学方程式:4HCOOH+K2CO3=2KH(HCOO)2+CO2↑+H2O.
②实际生产二甲酸钾时应选择的最佳反应条件是反应温度应控制在50℃∽60℃,反应物料比应选择4:1.由表1可知反应温度过高,反应回收率反而会降低,其原因可能是温度过高,甲酸易挥发.
(2)测定某弗米产品纯度的实验方法如下:
称取该弗米产品2.5g,将其全部溶解在水中,配制成250mL未知浓度的溶液,取出25.00mL于锥形瓶中,再滴加2~3滴指示剂,用0.10mol•L-1的NaOH溶液滴定至终点,消耗NaOH溶液的体积为18.50mL.
①加入的指示剂是酚酞(选填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至终点的现象是溶液由无色恰好变成浅红色且在半分钟内不褪色.
②上述弗米产品中二甲酸钾的质量分数为96.2%.
2.X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期.下列说法错误的是( )
| A. | 原子半径:Z>R>W | |
| B. | 气态氢化物稳定性:HmW>HnR | |
| C. | XW4分子中各原子均满足8电子结构 | |
| D. | Y、Z、R三种元素组成的化合物水溶液一定显碱性 |
19.下列反应离子方程式错误的是( )
| A. | 少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-=2HClO+SO32- | |
| B. | 碳酸钙中滴入醋酸溶液:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ | |
| C. | 碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O | |
| D. | 硫酸亚铁溶液中加过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O |