题目内容
4. 金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.(1)写出钢铁表面吸附的水膜酸性很弱或呈中性时的正极材料是C,其电极反应式为2H2O+O2+4e-=4OH-,列举几种常见的金属防腐蚀的电化学方法牺牲阳极的阴极保护法、外加电源的阴极保护法(写出两种).
(2)钢铁的表面发蓝、发黑处理也是常用的防腐方法.
下列反应是主要反应之一.请配平方程式:口 Na2FeO2+口 NaNO2+口=口 NaFeO2+口 NH3↑+口 NaOH
(3)钢铁的“钝化”处理也能达到防腐目的,经冷、浓HNO3处理后,其表面有一层致密氧化物保护膜,但是加热或在HNO3中就不能“钝化”.不同浓度的 HNO3 与铁反应的还原产物很复杂,其分布曲线如图.
①如图可知,密度为 1.05g•mL-1的硝酸与铁反应时,其最多的还原产物是NH4+;密度大于1.35g•mL-1的硝酸与铁反应时,其还原产物主要是 NO2;分析HNO3 与铁反应的规律是:硝酸的浓度越大,其还原产物中氮元素化合价越高.
②m g 铁与含 n g HNO3的硝酸溶液恰好完全反应,若硝酸的还原产物只有 NO,则 m 的取值可能是B、C、D(填字母编号)
A.$\frac{1}{5}$n B.$\frac{2}{9}$n C.$\frac{1}{4}$n D.$\frac{1}{3}$n E.$\frac{1}{2}$n
③工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是:硝酸易挥发,不稳定,见光易分解,故不易操作,生成物对环境污染严重.
分析 (1)钢铁锈蚀正极为C,电极反应为氧气得电子生成氢氧根离子,根据原电池原理的和电解池原理分析金属防腐蚀的电化学方法;
(2)根据元素化合价变化,结合电子守恒、原子守恒分析化学方程式中化学计量数;
(3)①根据图象知,该条件下,硝酸主要被还原为NH4+,根据还原产物中氮元素化合价分析解答;
②生成硝酸铁时,溶解Fe的质量最小,生成硝酸亚铁时溶解Fe的质量最大,根据电子转移守恒表示出NO的物质的量,再根据N原子守恒确定m、n关系,据此解答;
③浓硝酸具有易挥发,见光分解,生成产物污染空气等性质;
解答 解:(1)钢铁锈蚀正极为C,在吸附的水膜酸性很弱或呈中性时,电极反应为2H2O+O2+4e-=4OH-,金属防腐蚀的电化学方法一是利用原电池原理的牺牲阳极的阴极保护法,另一个为利用电解池原理的外加电源的阴极保护法;故答案为:C;2H2O+O2+4e-=4OH-;牺牲阳极的阴极保护法、外加电源的阴极保护法;
(2)分析化合价变化,铁元素化合价从+2价变化为+3价,氮元素化合价从+3价变化为-3价,
Na2FeO2~NaFeO2~e-,NaNO2~NH3~6e-
依据电子守恒Na2FeO2的配平系数为6,NaFeO2的配平系数为6,NaNO2和NH3的配平系数为1,
依据原子守恒配平NaOH,配平系数为7,根据原子守恒,缺项为H2O,H2O的配平系数为5,
化学方程式为:6Na2FeO2+NaNO2+5H2O═6NaFeO2+NH3↑+7NaOH,
故答案为:6;1;5H2O;6;1;7;
(3)①根据图象知,该条件下,硝酸主要被还原为NH4+,硝酸的浓度越大,其还原产物中氮元素化合价越高,
故答案为:NH4+;硝酸的浓度越大,其还原产物中氮元素化合价越高;
②生成硝酸铁时,溶解Fe的质量最小,根据电子转移守恒n(NO)=$\frac{mg}{56g/mol}$×$\frac{3}{5-2}$=$\frac{m}{56}$mol,
根据氮原子守恒可知n(HNO3)=n(NO)+3n[Fe(NO3)3],即$\frac{m}{56}$mol+$\frac{m}{56}$mol×3=$\frac{ng}{63g/mol}$,整理得整理得m=$\frac{2}{9}$n,
生成硝酸亚铁时溶解Fe的质量最大,根据电子转移守恒n(NO)=$\frac{mg}{56g/mol}$×$\frac{2}{5-2}$=$\frac{m}{84}$mol,
根据氮原子守恒可知n(HNO3)=n(NO)+2n[Fe(NO3)2],
则$\frac{m}{84}$mol+2×$\frac{m}{56}$mol=$\frac{ng}{63g/mol}$,整理得m=$\frac{1}{3}$n
故m的取值范围为:$\frac{2}{9}$n≤m≤$\frac{1}{3}$n,B、C、D都符合,
故答案为:B、C、D;
③工业上一般不用冷浓硝酸进行铁表面处理,浓硝酸具有易挥发,见光分解,生成产物污染空气等性质,
故答案为:硝酸易挥发,不稳定,见光易分解,故不易操作,生成物对环境污染严重;
点评 本题考查了电化学的装置原理、氧化还原反应的配平及计算,硝酸性质的图象分析,金属的腐蚀与防护,题目难度较大.配平的关键是分析化合价的变化,把变价元素配平,再根据原子守恒配平其他原子或物质.

 53随堂测系列答案
53随堂测系列答案| A. | NH4+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、Cl-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、NO3- | D. | Na+、Ca2+、Cl-、AlO2- |
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷可自燃而氮气需在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色晶体加入氢氧化钠浓溶液中并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该晶体中一定有NH4+ |
| A. | ②③⑤ | B. | ①②③ | C. | ③④⑤ | D. | ①③⑤ |
 ( )
( )| A. | W的氢化物比R的氢化物稳定 | |
| B. | T的最高价氧化物水化物可能为强碱 | |
| C. | Q的原子半径比T的小 | |
| D. | W和Q的原子序数相差10 |
| A. | 用湿润的KI-淀粉试纸鉴别Br2(g)和NO2(g) | |
| B. | 用新制Cu(OH)2悬浊液鉴别乙醛和丙醛 | |
| C. | 将CH4与CH2=CH2混合气体依次通过酸性KMnO4溶液、浓硫酸可得到纯净的CH4 | |
| D. | 用托盘天平、量筒、烧杯、玻璃捧配制10%的NaCl溶液 |
| A. | 原子半径:Z>R>W | |
| B. | 气态氢化物稳定性:HmW>HnR | |
| C. | XW4分子中各原子均满足8电子结构 | |
| D. | Y、Z、R三种元素组成的化合物水溶液一定显碱性 |
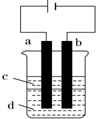 有H、O、N、Na四种元素:
有H、O、N、Na四种元素: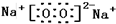 ;由两种元素组成的既有极性键又有非极性共价键物质的结构式是(写一种)H-O-O-H;
;由两种元素组成的既有极性键又有非极性共价键物质的结构式是(写一种)H-O-O-H;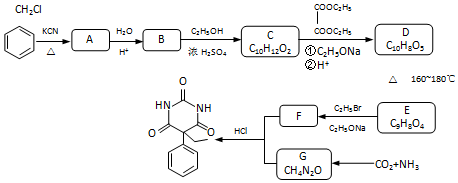
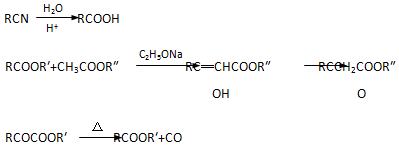
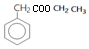 ;GCO(NH2)2.
;GCO(NH2)2.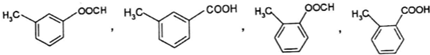 .
.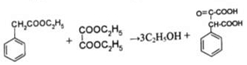 .
.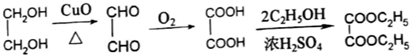 .
.