题目内容
14.铝土矿的主要成分为氧化铝,还有少量的氧化铁和二氧化硅杂质.工业上经过下列工艺可以冶炼金属铝: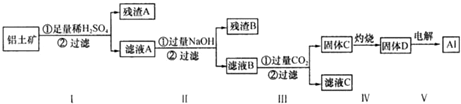
下列说法中正确的是( )
| A. | 滤液A 可用于净水,其净水原理为Al3++3H2O═Al(OH)3+3H+ | |
| B. | 固体C→固体D 的操作过程中主要仪器是酒精灯、蒸发皿、玻璃棒 | |
| C. | 滤液C 中存在以下关系:c(Na+)=c(SO42-)+2 c(CO32-)+c(HCO3-)+c(OH-)-c(H+) | |
| D. | 若在100 mL 滤液B 中加入1 mol•L-1HCl 200 mL,沉淀达到最大且质量为11.7 g,则滤液B 中c(Na+)大小2 mol•L |
分析 SiO2和盐酸不反应,Fe2O3和NaOH溶液不反应而Al2O3能反应,向NaAlO2中通入过量的CO2可以生成Al(OH)3沉淀;
铝土矿加入足量稀硫酸可生成硫酸铝、硫酸铁,残渣A为二氧化硅,滤液A中含有硫酸铁、硫酸铝,加入过量NaOH溶液,得到残渣B为Fe(OH)3,滤液B为AlO2-,
步骤③通入二氧化碳,生成的沉淀为Al(OH)3,经过滤、洗涤、灼烧可得Al2O3,电解可得到铝,据此分析解答.
解答 解:SiO2和盐酸不反应,Fe2O3和NaOH溶液不反应而Al2O3能反应,向NaAlO2中通入过量的CO2可以生成Al(OH)3沉淀;
铝土矿加入足量稀硫酸可生成硫酸铝、硫酸铁,残渣A为二氧化硅,滤液A中含有硫酸铁、硫酸铝,加入过量NaOH溶液,得到残渣B为Fe(OH)3,滤液B为AlO2-,
步骤③通入二氧化碳,生成的沉淀为Al(OH)3,经过滤、洗涤、灼烧可得Al2O3,电解可得到铝,
A.通过以上分析知,滤液A 的主要成分为氯化铝,其净水原理为Al3++3H2O?Al(OH)3+3H+,由于水解程度小,不能用等号,故A错误;
B.在坩埚中灼烧Al(OH) 3得Al 2O3,故B错误;
C.滤液C 为NaHCO3、Na2SO4的混合溶液,根据电荷守恒有:c(Na+)=2 c(SO42-)+2 c(CO32-)+c(HCO3-)+c(OH-)-c(H+),故C 错误;
D.滤液B 为NaOH、NaAlO2、Na2SO4的混合物,加入盐酸生成Al(OH) 311.7g,即n(NaAlO2)=0.15mol,NaOH、NaAlO2转化为NaCl,故c(Na +)>0.2mol•L-1,故D正确;
故选D.
点评 本题以框图题形式考查铝的化合物的性质,为高频考点,侧重于学生的分析能力和实验能力的考查,清楚流程图中发生的反应及各物质的成分及其性质是解本题关键,注意D选项的计算方法,题目难度中等.

| A. | NH4+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、Cl-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、NO3- | D. | Na+、Ca2+、Cl-、AlO2- |
| A. | 用湿润的KI-淀粉试纸鉴别Br2(g)和NO2(g) | |
| B. | 用新制Cu(OH)2悬浊液鉴别乙醛和丙醛 | |
| C. | 将CH4与CH2=CH2混合气体依次通过酸性KMnO4溶液、浓硫酸可得到纯净的CH4 | |
| D. | 用托盘天平、量筒、烧杯、玻璃捧配制10%的NaCl溶液 |
| A. | 原子半径:Z>R>W | |
| B. | 气态氢化物稳定性:HmW>HnR | |
| C. | XW4分子中各原子均满足8电子结构 | |
| D. | Y、Z、R三种元素组成的化合物水溶液一定显碱性 |

请回答下列问题:
(1)与以硫铁矿为原料的生产工艺相比,该工艺的特点是A.
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(2)气体a的成分是二氧化硫和氧气.
(3)进入接触室的气体,须先经过净化室的原因是防止混合气体中的灰尘、水蒸气等在接触室中导致催化剂中毒.
①吸收塔中吸收SO3的物质名称是98.3%浓硫酸.
②以SO2和O2为原料,利用电化学原理也可以制备硫酸,装置如图2电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.B极的电极反应式为SO2-2e-+2H2O═SO42-+4H+.
③吸收塔排出的尾气先用氨水吸收,得到铵盐M,再用浓硫酸 处理M,得到较髙浓度的SO2.SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2时发生反应的离子方程式是SO2-2e-+2H2O═SO42-+4H+.
④为确定③中铵盐M的成分,将不同质量的铵盐分别加入50.00ml相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解),测得标准状况下NH3的体积如表:
| 铵盐的质量/g | 2.15 | 4.30 | 6.45 |
| NH3的体积/mL | 672 | 1344 | 1344 |
| A. | 少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-=2HClO+SO32- | |
| B. | 碳酸钙中滴入醋酸溶液:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ | |
| C. | 碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O | |
| D. | 硫酸亚铁溶液中加过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O |
| A. | 盐酸 | B. | 硫酸 | C. | 氨水 | D. | NaOH溶液 |
①某物质经科学测定只含有一种元素,不可以断定该物质一定是一种纯净物;
②过量铁粉在氯气中燃烧生成FeCl2
③浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸;
④医疗上用的“钡餐”其成分是碳酸钡,漂白粉的成分为次氯酸钙;
⑤高压钠灯发出的黄光射程远,透雾能力强,故可做航标灯
⑥能与酸反应的氧化物,一定是碱性氧化物.
| A. | ①②③ | B. | ①③⑤ | C. | ②④⑥ | D. | ②③⑤ |
| A | B | C | D |
 |  |  |  |
| NH3 | C2H2 | CCl4 | CO2 |
| A. | A、 | B. | B | C. | C | D. | D |