题目内容
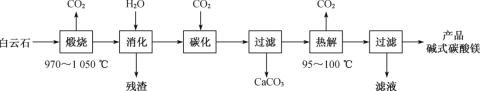
【题目】碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]是一种重要的无机化工产品。一种由白云石[主要成分为CaMg(CO3)2,含少量SiO2、Fe2O3等]为原料制备碱式碳酸镁(国家标准中CaO的质量分数≤0.43%)的实验流程如下:
(1)“煅烧”时发生主要反应的化学方程式为___。
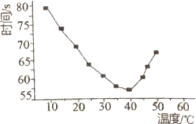
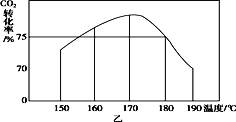
(2)常温常压下,“碳化”可使镁元素转化为Mg(HCO3)2,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
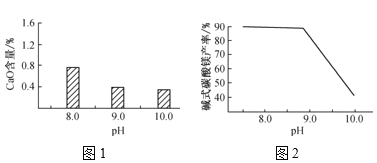
①应控制“碳化”终点pH约为___,钙元素的主要存在形式是___(填化学式)。
②根据图2,当pH=10.0时,镁元素的主要存在形式是___(填化学式)。
(3)“热解”生成碱式碳酸镁的化学方程式为___。
(4)该工艺为达到清洁生产,可以循环利用的物质是___(填化学式)。
【答案】CaMg(CO3)2![]() CaO+MgO+2CO2↑ 9.0 CaCO3 Mg(OH)2 5Mg(HCO3)2
CaO+MgO+2CO2↑ 9.0 CaCO3 Mg(OH)2 5Mg(HCO3)2![]() 4MgCO3·Mg(OH)2·4H2O↓+6CO2↑ CO2
4MgCO3·Mg(OH)2·4H2O↓+6CO2↑ CO2
【解析】
白云石[主要成分为CaMg(CO3)2,含少量SiO2、Fe2O3等]在高温下焙烧,其中CaMg(CO3)2分解生成CaO、MgO和CO2,再加水“消化”,其中MgO、CaO均与水反应生成Mg(OH)2和Ca(OH)2,经过滤除去SiO2、Fe2O3等残渣,再向所得溶液中通入CO2气体进行碳化,使得Mg(OH)2转化为可溶的Mg(HCO3)2,经过滤除去CaCO3,将所得Mg(HCO3)2溶液加热并控制温度95100![]() 即得到碱式碳酸镁,最后过滤并洗涤得到产品,据此分析作答;
即得到碱式碳酸镁,最后过滤并洗涤得到产品,据此分析作答;
(1) CaMg(CO3)2的煅烧分解类似于CaCO3、MgCO3 的高温分解,CaMg(CO3)2![]() CaO+MgO+2CO2↑;
CaO+MgO+2CO2↑;
(2) ①由图象可知,应控制“碳化”终点pH约为9.0,这时碱式碳酸镁产率较高,而CaO含量较低;煅烧产物CaO和MgO都可与水反应生成Ca(OH)2和Mg(OH)2,结合产物的要求,所以“碳化”时发生的主要反应有Mg(OH)2+2CO2=Mg(HCO3)2 和Ca(OH)2+CO2= CaCO3↓+H2O,钙元素存在的主要形式为CaCO3,故答案为:9.0;CaCO3;
②当pH= 10.0时,镁元素的主要存在形式是Mg(OH)2;
(3)由Mg(HCO3)2受热分解生成碱式碳酸镁的化学方程式为5Mg(HCO3)2 ![]() 4MgCO3·Mg(OH)2 ·4H2O↓+6CO2↑;
4MgCO3·Mg(OH)2 ·4H2O↓+6CO2↑;
(4)由流程图可知,可循环利用的物质有CO2。

 优生乐园系列答案
优生乐园系列答案