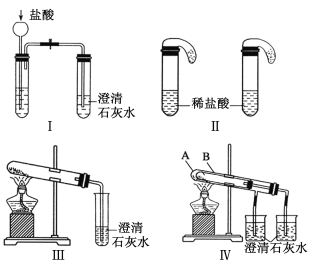
题目内容
【题目】已知同温、同浓度时,酸性:H2SO3>H2CO3>HSO3- >HCO3-
【1】用方程式表示NaHSO3溶液中存在的三个平衡体系(不考虑亚硫酸的分解):
①_________、②_________、③_________。
【2】0.1 mol L-1 的 NaHSO3溶液中离子浓度:c(SO32-)______c(HSO3-)(填 “>”、“<”或“=”);要使其中的c(H+)和c(SO32-)都减小,可行的方法是________________。
A 加入过量CaO(s) B 加入少量NaOH(s) C 通入过量HCl(g) D 加入少量的H2O2(aq)
【3】0.1mol L的Na2SO3溶液呈____性(填“酸”、“碱”或“中”),其电荷守恒式: c(Na+)+c(H+)=_______。
【4】H2SO3和NaHCO3溶液的离子方程式为:___________。
【5】NaHSO3溶液在不同温度下均可被过量KIO3酸性溶液氧化,当NaHSO3完全消耗即I2有析出,写出该反应的离子方程式:___________。
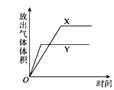
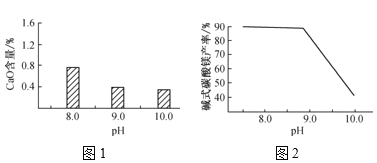
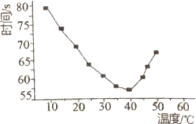
【6】将NaHSO3(含少量淀粉)和酸性溶液KIO3(过量)混合,记录10-50℃间溶液变蓝时间,实验結果见下图。请描述曲线变化的规律________。
【答案】
【1】 HSO3- +H2O ![]() H2SO3+OH- HSO3-
H2SO3+OH- HSO3- ![]() SO32-+ H+ H2O
SO32-+ H+ H2O![]() H++OH-
H++OH-
【2】 > A
【3】 碱 c(Na+) + c(H+) = 2c(SO32-) + c(HSO3-)+c(OH-)
【4】H2SO3 + HCO3- = CO2↑+HSO3-+H2O
【5】5HSO3- + 2IO3- = 5SO42- + I2 + H2O +3H+
【6】温度低于40℃之前,温度越高,反应速率越快,变蓝时间越短,温度高于40℃低于50℃,溶液变蓝时间变长
【解析】
亚硫酸钠溶液中存在三个平衡,水的电离、亚硫酸根的电离、亚硫酸根的水解,
亚硫酸根主要是电离为主,水解次要,利用平衡移动原理分析离子浓度的变化,
利用酸性强弱书写离子方程式,
利用氧化还原反应原理来配平离子方程式,
读图像,根据图像变化趋势分析化学问题。
【1】NaHSO3溶液中存在的三个平衡体系分别是亚硫酸氢根的水解,亚硫酸根的电离,水的电离,离子方程式分别为HSO3- +H2O ![]() H2SO3+OH-,HSO3-
H2SO3+OH-,HSO3- ![]() SO32-+ H+,H2O
SO32-+ H+,H2O![]() H++OH-,
H++OH-,
故答案为:HSO3- +H2O ![]() H2SO3+OH-;HSO3-
H2SO3+OH-;HSO3- ![]() SO32-+ H+;H2O
SO32-+ H+;H2O![]() H++OH-;
H++OH-;
【2】0.1 mol L-1 的 NaHSO3溶液中,HSO3- +H2O ![]() H2SO3+OH-,HSO3-
H2SO3+OH-,HSO3- ![]() SO32-+ H+,电离平衡大于水解平衡,因此离子浓度:c(SO32-) > c(HSO3-);
SO32-+ H+,电离平衡大于水解平衡,因此离子浓度:c(SO32-) > c(HSO3-);
要使其中的c(H+)和c(SO32-)都减小,
A选项,过量CaO(s)和氢离子反应生成水和钙离子,钙离子又和亚硫酸根反应生成亚硫酸钙沉淀,故A正确;
B选项,少量NaOH(s)和氢离子反应,HSO3- ![]() SO32-+ +,平衡正向移动,亚硫酸根离子浓度增大,故B错误;
SO32-+ +,平衡正向移动,亚硫酸根离子浓度增大,故B错误;
C选项,通入过量HCl(g),平衡逆向移动,氢离子浓度增大,故C错误;
D选项,加入少量的H2O2(aq),双氧水和亚硫酸根反应生成硫酸根、氢离子和水,氢离子浓度增大,故D错误;
综上所述,答案为A,
故答案为:>;A;
【3】0.1mol L的Na2SO3溶液,由于亚硫酸根水解,强碱弱酸盐,水解显碱性,根据电荷守恒,阳离子所带电荷等于阴离子所带电荷,其电荷守恒式:c(Na+) + c(H+) = 2c(SO32-) + c(HSO3-)+c(OH-),
故答案为:碱;c(Na+) + c(H+) = 2c(SO32-) + c(HSO3-)+c(OH-);
【4】由于酸性大小顺序为:H2SO3>H2CO3>HSO3->HCO3-
因此H2SO3和NaHCO3溶液的离子方程式为:H2SO3 + HCO3- = CO2↑+HSO3-+H2O,
故答案为:H2SO3 + HCO3- = CO2↑+HSO3-+H2O;
【5】NaHSO3溶液在不同温度下均可被过量KIO3酸性溶液氧化,当NaHSO3完全消耗即I2有析出,按照化合价升降守恒,NaHSO3升高2个价态,生成I2降低10个价态,NaHSO3系数配5,I2系数配1,KIO3系数配2,因此该反应的离子方程式:
5HSO3- + 2IO3- = 5SO42- + I2 + H2O +3H+,
故答案为:5HSO3- + 2IO3- = 5SO42- + I2 + H2O +3H+;
【6】6. 将NaHSO3(含少量淀粉)和酸性溶液KIO3(过量)混合,记录10-50℃间溶液变蓝时间,实验結果见下图。请描述曲线变化的规律温度低于40℃之前,温度越高,反应速率越快,变蓝时间越短,温度高于40℃低于50℃,溶液变蓝时间变长,温度高于50℃,淀粉不适宜作指示剂,
故答案为:温度低于40℃之前,温度越高,反应速率越快,变蓝时间越短,温度高于40℃低于50℃,溶液变蓝时间变长。