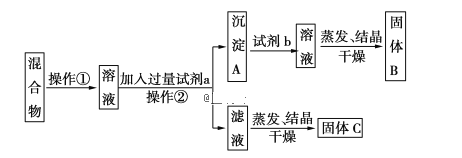
题目内容
【题目】把5.1 g铝镁合金的粉末放入100 mL某盐酸中,恰好完全反应,标准状况下收集到5.6 L H2。试计算(注意:无计算过程不给分):
(1)该盐酸的物质的量浓度是多少?_____________
(2)该合金中铝的质量为多少克?_____________
【答案】5mol/L 2.7g
【解析】
镁铝合金与盐酸发生反应的化学方程式为:Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,生成氢气的物质的量为n(H2)=![]() =0.25mol,结合反应的方程式列方程式计算出盐酸的物质的量浓度、合金中铝的质量。
=0.25mol,结合反应的方程式列方程式计算出盐酸的物质的量浓度、合金中铝的质量。
标况下5.6L氢气的物质的量为0.25mol,设5.1g镁铝合金中含有镁物质的量为xmol,含有铝物质的量为ymol,则
Mg+2HCl=MgCl2+H2↑
1 2 1
x 2x x
2Al+6HCl=2AlCl3+3H2↑
2 6 3
y 3y 1.5y
x+1.5y=0.25
24x+27y=5.1
解得:x=0.1;y=0.1
(1)反应消耗的盐酸的总物质的量为:0.1mol×2+0.1mol×3=0.5mol,盐酸的物质的量浓度为:c(HCl)=![]() =5mol/L,
=5mol/L,
故该盐酸的物质的量浓度为5mol/L;
(2)该合金中铝的质量m(Al)=n×M=0.1mol×27g/mol=2.7g
故该合金中铝的质量2.7g。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】C1O2是常用的自来水消毒剂。
I.已知实验室可用亚氯酸钠固体与氯气反应制备ClO2:2NaClO2+C12 =2C1O2+2NaCl,装置如下图所示:

(1)圆底烧瓶内发生反应的化学方程式是:__________。
(2)已知常温常压下,ClO2和Cl2是气体,在下列溶剂中溶解性如下表所示:
ClO2 | Cl2 | |
水 | 极易溶于水 | 溶 |
CCl4 | 难溶 | 溶 |
B、C、E装置中的试剂依次是_________(填序号)。
a.NaOH溶液 b.浓硫酸 c.饱和食盐水 d.CCl4 e.饱和石灰水
II.使用C1O2在给自来水消毒的过程中会产生有害的副产物亚氯酸根(ClO2-),可用Fe2+将其去除。已知ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,而ClO2-则被还原成Cl-。
(3)Fe2+消除ClO2-的离子方程式为_______。
(4)实际向自来水中加入Fe2+的量要高于理论值,原因是(结合离子方程式解释)___________。