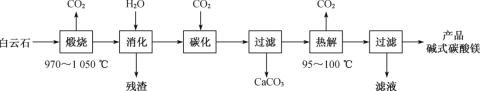
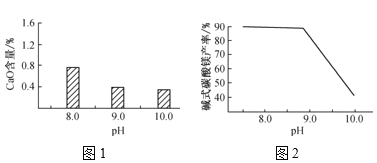
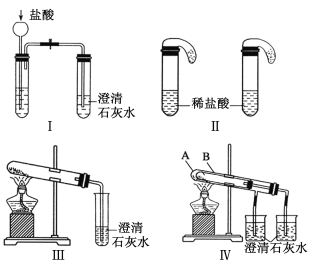
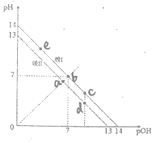
题目内容
【题目】室温下,2H2(g)+O2(g)![]() 2H2O(l)+566kJ。下列说法错误的是
2H2O(l)+566kJ。下列说法错误的是
A.H2![]() H+H的过程需要吸热
H+H的过程需要吸热
B.若生成2mol水蒸气,则放出的热量大于566kJ
C.2g氢气完全燃烧生成液态水所释放的能量为283kJ
D.2mol氢气与1mol氧气的能量之和大于2mol液态水的能量
【答案】B
【解析】
A. 化学键断裂需要吸热,所以H2![]() H+H的过程需要吸热,故A正确;
H+H的过程需要吸热,故A正确;
B. 水蒸气的能量大于液态水,若生成2mol水蒸气,则放出的热量小于566kJ,故B错误;
C. 根据2H2(g)+O2(g)![]() 2H2O(l)+566kJ ,4g氢气完全燃烧生成液态水所释放的能量为566kJ,所以2g氢气完全燃烧生成液态水所释放的能量为283kJ,故C正确。
2H2O(l)+566kJ ,4g氢气完全燃烧生成液态水所释放的能量为566kJ,所以2g氢气完全燃烧生成液态水所释放的能量为283kJ,故C正确。
D. 2H2(g)+O2(g)![]() 2H2O(l)反应放热,2mol氢气与1mol氧气的能量之和大于2mol液态水的能量,故D正确;
2H2O(l)反应放热,2mol氢气与1mol氧气的能量之和大于2mol液态水的能量,故D正确;
选B。

 阅读快车系列答案
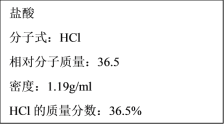
阅读快车系列答案【题目】(10分)某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。
(1)该同学应选择________mL的容量瓶。
(2)其操作步骤如下图所示,
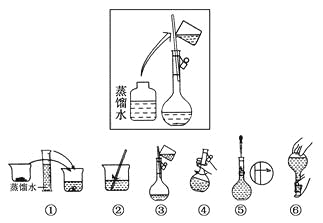
则如图操作应在下图中的________(填选项字母)之间。
A.②与③ B.①与② C.④与⑤
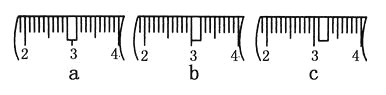
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。
附表 砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏大”、“偏小”或“无影响”,下同)
②容量瓶中原来有少量蒸馏水,浓度会________。