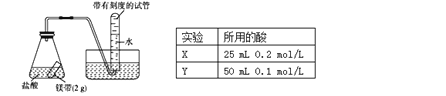
题目内容
【题目】将高碘酸H5IO6加入MnSO4溶液中可使溶液呈紫红色,已知H5IO6在反应中发生如下过程:H5IO6→HIO3。完成下列填空:
(1)将该反应的氧化剂、还原剂及配平后的系数填入正确位置,并用单线桥法标明电子转移的方向和数目。________________
(2)生成2 mol的HIO3转移的电子数为___________
(3)若向H5IO6溶液中加入足量的下列物质,能将碘元素还原成I的是_____(选填序号)
a.盐酸 b.硫化氢 c.溴化钠 d.硫酸亚铁
(4)若向H5IO6的溶液中加入过量的过氧化氢溶液,再加入淀粉溶液,溶液变蓝,同时有大量气体产生。请写出此反应的化学方程式:___________________
【答案】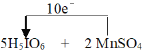 4NA b 2H5IO6+7H2O2=I2+12H2O+7O2↑
4NA b 2H5IO6+7H2O2=I2+12H2O+7O2↑
【解析】
⑴根据氧化还原反应原理进行方程式配平得到5H5IO6+2MnSO4=2HMnO4+5HIO3+2H2SO4+7H2O,因此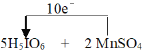 ,故答案为:
,故答案为: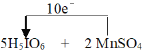 。
。
⑵根据反应方程式转移10mol电子生成5molHIO3,则生成2mol的HIO3转移电子物质的量为4mol,其转移的电子数为4NA,故答案为:4NA。
⑶H5IO6溶液与盐酸反应生成氯气和碘离子,而氯气要氧化碘离子,因此不能将碘元素还原成I;H5IO6溶液与硫化氢反应生成硫单质和碘离子,相互共存,因此能将碘元素还原成I;H5IO6溶液与溴化钠反应生成溴单质和碘离子,溴单质和碘离子不共存,因此不能将碘元素还原成I;H5IO6溶液与硫酸亚铁反应生成铁离子和碘离子,不共存,因此不能将碘元素还原成I;故答案为b。
⑷若向H5IO6的溶液中加入过量的过氧化氢溶液,再加入淀粉溶液,溶液变蓝说明有单质碘生成,同时有大量气体产生说明有氧气生成,其化学方程式:2H5IO6+7H2O2=I2+12H2O+7O2↑,故答案为:2H5IO6+7H2O2=I2+12H2O+7O2↑。

 名校课堂系列答案
名校课堂系列答案【题目】POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
I.制备PCl3
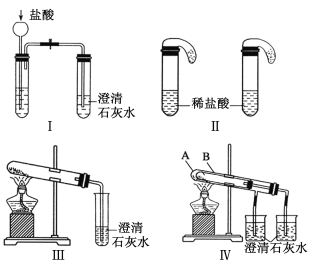
(1)实验室用高锰酸钾和浓盐酸反应制氯气。发生装置可以是图中的____(填字母代号)。
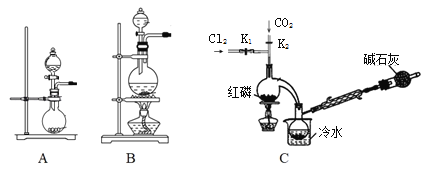
(2)检查装置C气密性并装入药品后,先关闭K1,打开K2通入干燥的CO2,一段时间后,关闭K2,加热曲颈瓶同时打开K1通入干燥氯气,反应立即进行。图中碱石灰的作用是______________。
II.实验室制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:
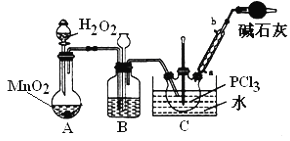
资料:①Ag++SCN﹣=AgSCN↓,Ksp(AgCl)>Ksp(AgSCN);
②PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | ﹣112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POCl3 | 2.0 | 106.0 | 153.5 |
(3)POCl3在潮湿空气中会剧烈“发烟”,反应的化学方程式为___________________________________。
(4)反应温度要控制在60~65℃,原因是:_________________________________。
(5)通过佛尔哈德法可以测定产品中Cl元素含量,实验步骤如下:
a、准确称取15.0 g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL溶液。
b、取10.00 mL溶液于锥形瓶中,加入10.00 mL 3.2 molL﹣1 AgNO3标准溶液。
c、加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
d、以NH4Fe (SO4) 2为指示剂,用0.2 molL﹣1 NH4SCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mL NH4SCN溶液。
①步骤d中达到滴定终点的现象是__________________________________________。
②产品中Cl元素的质量分数为______________(保留3位有效数字)。