��Ŀ����
����Ŀ��ij��ѧ�о���ѧϰС�����ʵ��̽��ͭ�ij�����ѧ���ʣ�����������£��������
����1�������ڱ��У�ͭ������λ�úܽӽ���ͭ���������ã����������������ԣ�������ͭҲ��������
����2������ͭ���б�ۣ�һ������£������������ȶ���С�������۵�������һ��ͭ���ȶ���ҲС�������۵�ͭ��
����3������ͭ�������ԣ��ܱ�H2��CO��ԭ����Ҳ�ܱ�����ij����̬�⻯�ﻹԭ��
ʵ��̽��
��1��I���������1a.���õ���ҩƷ��1molL��1CuSO4��Һ��ϡ������������Լ��Ļ�ѧʽ����Һ��
b.�õ�����������1molL��1CuSO4��Һ250mL��ѡ�õ��������ձ���������ƽ��ҩ�ס�
����������ͷ�ι��⣬���������������ƣ���
c.Ϊ�ﵽʵ��Ŀ�ģ����㲹ȫʵ�����ݺͲ��裺
����CuSO4��Һ�Ʊ�Cu��OH��2��
�� ��
��2���������2ȡһ����I���Ʊ���õ�������ͭ���������������գ����¶ȴﵽ80��100��õ���ɫ�����ĩ������������1000�����ϣ���ɫ��ĩȫ����ɺ�ɫ��ĩ������ͭ��ȡ������ɫ������ͭ��ĩ�ڽྻ�Թ��У����������ϡ���ᣨ�����ᣩ���õ���ɫ��Һ��ͬʱ�۲쵽�Թܵײ����к�ɫ������ڣ���������ʵ������ش����⣮
a.д��������ͭ��ϡ���ᣨ�����ᣩ��Ӧ�����ӷ���ʽ�� ��
b.��ʵ���ɵó��Ľ������ڸ�������һ��ͭ��������ͭ�����ȶ����ȶ�����
��Һ����һ��ͭ��������ͭ�����ȶ����ȶ�����
��3���������3�������װ�ã��г�װ��δ��������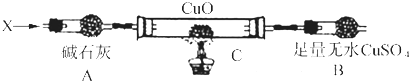
������ij����̬�⻯�X������ͨ�����ȵ�����ͭʱ���۲쵽����ͭ�ɺ�ɫ����˺�ɫ����ˮ����ͭ�����ɫ���������л���һ������Ⱦ�ĵ�������Y����Xͨ�����ȵ�CuOȼ�չ���ȫ��Ӧ������0.01mol X�����Bװ������0.36g�����ռ���0.28g����Y��
a.����A�������� ��
b.X�Ļ�ѧʽΪ ��
���𰸡�
��1��NaOH��Һ��250mL������ƿ����Cu��OH��2�ֱ����ϡ�����ϡNaOH��Һ�У��۲�����
��2��Cu2O+2H+=Cu+Cu2++H2O���ȶ������ȶ�
��3������ܣ�N2H4
���������⣺��1���������1a.Ҫ֤��Cu��OH��2�������ԣ�Ҫ֤��Cu��OH��2�������ԣ�Ӧ�ȼ��������Cu��OH��2 �� ����Ҫ����������ͭ�����Լ��Ӧ��ʵ�飬�ݴ�ѡ���Լ�1molL��1CuSO4��Һ��ϡ���ᡢ����������Һ�����Դ��ǣ�NaOH��Һ��b.��������һ�������һ�����ʵ���Ũ�ȵ���Һ���õ��������ձ���������ƽ��ҩ�ס�����������ͷ�ιܡ�250mL������ƿ�����Դ��ǣ�250mL������ƿ��c.֤��Cu��OH��2�������ԣ�Ӧ�ȼ��������Cu��OH��2 �� ����Ҫ����������ͭ�����Լ��Ӧ��ʵ�飬���Դ��ǣ���Cu��OH��2�ֱ����ϡ�����ϡNaOH��Һ�У��۲�����2���������2 a.������Ϣ����ɫ������ͭ��ĩ�ڽྻ�Թ��У����������ϡ���ᣨ�����ᣩ���õ���ɫ��Һ��ͬʱ�۲쵽�Թܵײ����к�ɫ���壬�����ӷ���ʽΪ��Cu2O+2H+=Cu+Cu2++H2O�����Դ��ǣ�Cu2O+2H+=Cu+Cu2++H2O��b.������Ϣ��������ͭ���壬�����������գ����¶ȴﵽ80��100��õ���ɫ�����ĩ������������1000�����ϣ���ɫ��ĩȫ����ɺ�ɫ��ĩ������ͭ�������ڲ�ͬ�¶��·�Ӧ�����ɿ�ȷ�����ʵ��ȶ��ԣ����Ը���1000��ʱCu2O��CuO�ȶ�������Һ�У�Cu2O+2H+=Cu+Cu2++H2O������Cu2+��Cu+�ȶ������Դ��ǣ��ȶ������ȶ�����3���������3 a.�����ṩ������ȷ��A��B�����Ǹ���ܣ����Դ��ǣ�����ܣ�b.����0.01mol X�����Bװ������0.36g��������0.02mol��ˮ�����ռ�����������Y 0.28g������0.01mol������ԭ���غ����ȷ����̬�⻯��X�к���4����ԭ�Ӻ�2����ԭ�ӣ�X�Ļ�ѧʽΪN2H4 �� ���Դ��ǣ�N2H4 ��