题目内容
【题目】往100mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M.通入的CO2的体积(标准状况)与M的质量的关系如图所示.试回答下列问题:
(1)A点时,白色固体M的化学式为 , 通入的CO2的体积为mL(标准状况下,下同).
(2)C点时,白色固体M的化学式为 , 通入的CO2的体积为mL.
(3)B点时M的组成成分为(用化学式表示),通入的CO2的体积为mL.
(4)该NaOH溶液的物质的量浓度为 .
【答案】
(1)Na2CO3;1120
(2)NaHCO3;2240
(3)Na2CO3、NaHCO3;1792
(4)1mol/L
【解析】解:由图知NaOH质量为4 g,物质的量为0.1 mol,完全转化为Na2CO3时,Na2CO3质量为0.1mol× ![]() ×106g/mol=5.3 g,完全转化为NaHCO3时,NaHCO3质量为0.1mol×84g/mol=8.4 g,故A点白色固体M为Na2CO3 , C点白色固体M为NaHCO3 , (1)由上述分析可知,A点白色固体M为Na2CO3 , 需CO2体积为0.1 mol×
×106g/mol=5.3 g,完全转化为NaHCO3时,NaHCO3质量为0.1mol×84g/mol=8.4 g,故A点白色固体M为Na2CO3 , C点白色固体M为NaHCO3 , (1)由上述分析可知,A点白色固体M为Na2CO3 , 需CO2体积为0.1 mol× ![]() ×22.4Lmol﹣1=1.12L=1120 mL,所以答案是:Na2CO3;1120;(2)由上述分析可知,C点白色固体M为NaHCO3 , 需CO2体积为0.1 mol×22.4Lmol﹣1=2.24L=2240 mL,所以答案是:NaHCO3; 2240;(3)图B点时M的质量为7.16 g,5.3<7.16<8.4,知M由Na2CO3和NaHCO3组成,设在B点时Na2CO3物质的量为x,NaHCO3物质的量为y,则:
×22.4Lmol﹣1=1.12L=1120 mL,所以答案是:Na2CO3;1120;(2)由上述分析可知,C点白色固体M为NaHCO3 , 需CO2体积为0.1 mol×22.4Lmol﹣1=2.24L=2240 mL,所以答案是:NaHCO3; 2240;(3)图B点时M的质量为7.16 g,5.3<7.16<8.4,知M由Na2CO3和NaHCO3组成,设在B点时Na2CO3物质的量为x,NaHCO3物质的量为y,则: ![]() 解得x=0.02,y=0.06, 故V(CO2)=(0.02 mol+0.06 mol)×22.4Lmol﹣1=1.792L=1792 mL所以答案是:Na2CO3、NaHCO3;1792;(4)该NaOH溶液的物质的量浓度为
解得x=0.02,y=0.06, 故V(CO2)=(0.02 mol+0.06 mol)×22.4Lmol﹣1=1.792L=1792 mL所以答案是:Na2CO3、NaHCO3;1792;(4)该NaOH溶液的物质的量浓度为 ![]() =1mol/L,所以答案是:1mol/L.
=1mol/L,所以答案是:1mol/L.

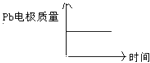
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.其反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);电解池:2Al+3H2O ![]() Al2O3+3H2↑,电解过程中,以下判断正确的是( )
Al2O3+3H2↑,电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e﹣=Pb2++2H2O | 阳极:2Al+3H2O﹣6e﹣=Al2O3+6H+ |
D |
|
|
A.A
B.B
C.C
D.D