题目内容
(15分)【化学—选修3:物质结构与性质】
a、b、c、d、f五种前四周期元素,原子序数依次增大;a、b、c三种元素的基态原子具有相同的能层和能级,第一电离能I1(a)<I1(c)<I1(b),且其中基态b原子的2p轨道处于半充满状态; d为周期表前四周期中电负性最小的元素;f的原子序数为29。请回答下列问题。(如需表示具体元素请用相应的元素符号)
(1)写出ac2的电子式__________;基态f原子的外围电子排布式为 。
(2)写出一种与ac2互为等电子体的物质的化学式 。
(3)b的简单氢化物的沸点比同族元素氢化物的沸点 。(填“高”或“低”)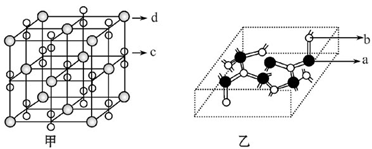
(4)化合物M由c、d两种元素组成,其晶胞结构如甲,则M的化学式为 。
(5)化合物N的部分结构如乙,N由a、b两元素组成,则硬度超过金刚石。试回答:①N的晶体类型为________________________,其硬度超过金刚石的原因是___________________。
②N晶体中a、b两元素原子的杂化方式均为___________________。
(除标注外,每空2分,共15分)
(1) 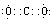 3d104s1
3d104s1
(2) N2O(写NO2+也计分)
(3) 高
(4) KO2
(5) ① 原子晶体 (1分)
C—N键的键长小于C—C键,C—N键的键能大于C—C键 (合理答案均计分) ②SP3
解析试题分析:a、b、c三种元素的基态原子具有相同的能层和能级,说明三种元素属于同周期元素,基态b原子的2p轨道处于半充满状态;所以b是N元素,第一电离能I1(a)<I1(c)<I1(b),则a、c分别是C、O元素;d为周期表前四周期中电负性最小的元素,则d是K元素;f的原子序数为29,f是Cu元素。
(1)二氧化碳的电子式为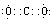 ;基态f原子的外围电子的排布式为3d104s1 ;
;基态f原子的外围电子的排布式为3d104s1 ;
(2)CO2是3原子16价电子的分子,与之互为等电子体的物质有N2O;
(3)N的氢化物是NH3,氨气分子间能形成氢键使沸点升高,所以b的简单氢化物的沸点比同族元素氢化物的沸点高;
(4)根据“均摊法”,甲中d的个数为8×1/8+6×1/6=4,c2的个数是12×1/4+1=4,所以M的化学式为KO2
(5)①N的硬度超过金刚石,所以N是原子晶体;N原子的半径比C小,所以C-N的键长比C-C的键长短键能大,共价键强,硬度大。
②N晶体中,C原子周围都是4个共价单键,所以是sp3杂化,N原子周围是3个根据单键,还有1对未成键电子,所以也是sp3杂化。
考点:考查元素推断,物质结构与性质的关系,晶胞计算,化学键的判断,电子式、分子式的书写

决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长
 与光的频率v的关系为
与光的频率v的关系为 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: 。(未说明原因不给分)
| 共价键 | C—C | C—N | C—S |
| 键能/kJ·mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5) [Cu(NH3)4]SO4中存在的化学键类型有 (填序号)。
A.共价键 B.氢键 C.离子键 D.配位键 E.分子间作用力
NH3分子的空间构型为 ,属于 分子(填“极性”或“非极性”)
(14分)下表列出了A—R九种元素在周期表中的位置,用元素符号或化学式填空。
 主族 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | E | | F | | |
| 3 | A | C | D | | | | G | R |
| 4 | B | | | | | | H | |
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是 。
(3)A、B、C三种元素按原子半径由大到小的顺序排列的为 。
(4)F的氢化物的电子式 ;G、H 氢化物的稳定性递减的顺序是 。
(5)H元素跟A元素形成的化合物的化学式是 ;A2F2的电子式是 ;。
(6)B和F两种元素形成的2:1型化合物属于 (填“离子化合物”或“共价化合物”),请用电子式表示其形成过程 。
(7)国际无机化学命名委员会在1989年作出决定, 把元素周期表的主、副族及其族号取消, 由左至右改为1~18列。按这个规定,第15列元素应为 族元素,其简单氢化物的化学式为 (用字母“M”表示该族元素)
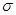 键和
键和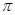 键数目之比为________,B、C、E三种元素的第一电离能由大到小的顺序为_________(用实际元素符号表示)。
键数目之比为________,B、C、E三种元素的第一电离能由大到小的顺序为_________(用实际元素符号表示)。 离子中B原子轨道的杂化类型为__________。
离子中B原子轨道的杂化类型为__________。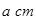 。该晶体的密度为________
。该晶体的密度为________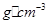 g(NA表示阿伏加德罗常数,E的相对原子质量为b)。
g(NA表示阿伏加德罗常数,E的相对原子质量为b)。
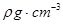 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞边长为_______cm(用含
,则晶胞边长为_______cm(用含  、
、